
摘要:目的 评价基于噬菌体展示技术的羟基磷灰石结合肽的解吸附特征。方法采用成品羟基磷灰石(hydroxyapatite,HAP)作为结合底物,通过X射线衍射(X-raydiffraction,XRD)对其进行物相鉴定,提取噬菌体 DNA 测序读取展示肽 的 序 列,扩增制备目标序列YSLHWGE(YSL)的 单 克 隆 储 液,以肽库中随机挑选的序列 VTDSKPK(VTD)为阴性对照;滴度测试测定投入回收比,免疫荧光法验证目标序列的标靶亲和力。参照标准淘选方案,在不同pH 值(7.5、6.5、5.5、4.5)缓冲洗脱液中分析目标序列的解吸附特征。结果 YSL和 VTD 的单克隆储液扩增后滴度均达到1011pfu/10μL,符合后续实验要求。测序结果得到目标序列和随机序列分别为 YSL和 VTD。通过重复3次滴度测试计算投入回收比发现,目标序列 YSL与 HAP的亲和度较高,投入回收比为随机肽 VTD投入回收比的17.5倍。这种结合亲和力也通过免疫荧光实验得以验证,结果显示 YSL组羟基磷灰石粉末被荧光点亮的面积比例和平均吸光度分别为(71.98±2.30)% 和 (0.10090±0.00544),均 显 著 高 于 VTD 组 的 (49.95±2.28)% (P<0.01)和 (0.04637±0.00117)(P<0.01);发现在不同pH 值环境中,YSL解吸附释放的噬菌体数量占原吸附总量的比例均高于随机肽 VTD解吸附的比例(P<0.01)。结论 羟基磷灰石结合肽序列 YSLHWGE 对结合底物羟基磷灰石有较好的亲和力且具有一定的随环境pH 值变化的缓释能力。
羟基磷灰石(hydroxyapatite,HAP)是人类骨组织和牙齿等天然硬组织组成部分中最稳定的磷酸钙,其具有优异的理化、生物性能,能与有机成分特异性结合[1]。而羟基磷灰石结合肽(hydroxyapatitebindingpeptides,HABPs)是 指 能 识 别 并 结 合 于HAP表面的生物活性肽。不少研究通过噬菌体展示技术鉴定 HABPs,并研究其体外结合亲和力[2-3]。众所周知,HAP主要由Ca2+ 、PO43- 组成,具有两性离子的特征,静电引力是导致 HAP 与蛋白质之间发生吸附最主要的一种作用力,而蛋白质分子往往带有一定量的电荷,所以 pH 值是一项重要的生理环境参数,对蛋白质在 HAP 表面的吸附具有重要影响[4]。我们前期通过噬菌体展示技术淘选目标HABPs时获得了一系列理想的 HAP结合序列,因体外合成成品 HABPs成本高、周期长,我们尝试利用 M13噬菌体作为载体以噬菌体展示状态进行实验。本文报道了其中一条与 HAP特异性结合力较好且解 吸 附 特 征 对 外 界 环 境 pH 值 改 变 敏 感 的HABPs序列 YSLHWGE(YSL),利用这种特质可结合抗菌药物制备口腔植入物的表面涂层,其可随着口腔唾液pH 值改变释放抗菌药物,起到控制牙菌斑的效果,具有一定的临床应用前景。
1 材料与方法
羟基磷灰石生物陶瓷 HAP(四川大学生物材料工程研究中心);X 射线衍射仪(德国 BrukerAXS,D8-Focus);倒 置 荧 光 显 微 镜 (OLYMPUS,TH4-200,日本 TOKYO);摇床(天呈,T-100C);电热恒温培养箱(上海精宏,DNP-9082);生物安全柜(苏州智净,BHC1300 ⅡA/B2型);数显恒温水浴锅(常州澳华,HH-4);超声波清洗机(新芝生物科技股份有限 公 司,SB-3200DTD );pH 计 (奥 豪 斯,STARTER3100)。
1.3 单克隆噬菌体储液的制备及其展示肽序列的测定
利用噬菌体随机肽库对 HAP 进行筛选,经多轮生物淘选和选择、噬菌体扩增获得多组具有不同底物亲和力的多肽序列,其中 YSLHWGE(YSL)通过滴定测量回收后的噬菌体数量显示对 HAP的结合亲和力较高用于后续实验。取目标序列(YSL)和随机序列 VTDSKPK(VTD)甘油存样各1μL,梯度稀释到合适的倍数,于IPTG/Xgal蓝白筛选平板上培养。取单个蓝色噬菌斑进行扩增,测试扩增液滴度并提取噬菌体 DNA 测序 (QIAprepSpin M13,NewEnglandBiolabs,USA)以确定产物序列的准确性。
将载有目标序列 YSL 或随机序列 VTD 的单克隆噬菌体分别与 HAP 结合,通过滴定测量回收后的噬菌体数量,计算最初投入的噬菌体与回收液的噬菌体之间的比值以评价这2个结合肽序列对HAP的结合亲和力。随着噬菌体与底物结合亲和力的提高,噬菌体的投入回收比值变大。
1.4.1 载有 YSL或 VTD的单克隆噬菌体与 HAP结合 配制pH=8.5的 TBST 缓冲液[含0.15(V/V)吐温20]用于本实验。依照常规洗脱方案,将底物 HAP依次使用去离子水、无水乙醇、去离子水超声振荡5min后高温高压灭菌40min,再置于90℃10%氢氧化钠溶液中浸泡1h后使用大量去离子水清洗 HAP 至 中 性,加 入 10 mL TBST 缓 冲 液 中37℃温 和 摇 床 过 夜,吸 取 过 夜 液 体 加 入 封 闭 液 1mL,37℃ 温 和 摇 床 封 闭 1h,吸 取 封 闭 液 后 使 用TBST 缓冲液清洗 HAP 数次,分别于管中投入等量1.2×1011pfu的目标肽序列 YSL 及随机肽序列VTD单克隆噬菌体,37℃温和摇床进行孵育1h后吸去管中未结合的噬菌体,然后用10mL新鲜配置的 TBST 缓冲液清洗多次以去除残余未结合的噬菌体,加入非特异性缓冲液1mL37℃温和摇床10min后加入150μLTris-HCl缓冲液。通过滴度测试测得目标肽序列 YSL 和随机肽序列 VTD 用非特异性洗脱液洗脱的滴度结果,实验重复3次。
1.4.2 单克隆噬菌体滴定测试 挑选目标序列和随机序列的 LB/Tet培养基平板上分离培养的宿主菌 ER2738的单克隆菌斑,于含10μL 四环素的10mLLB培养液中37℃剧烈振荡6~8h培养至感染状态备用。同期微波融化顶层琼脂后分装于新鲜灭菌的离心管中,48℃温浴备用。将待滴度测试的噬菌体用 LB培养液做适当的稀释后加入菌液快速混匀倒入新鲜配置的 LB/IPTG/Xgal平板,室温静置3min后倒置放入培养箱内37℃过夜培养。外膜蛋白上含有展示肽噬菌体能在 LB/IPTG/Xgal平板上形成蓝色的噬菌斑。
计算大约含有100个噬菌体计数平板上蓝色噬菌体的数量,按照下列公式计算噬菌体的滴度:噬菌体的滴度(pfu/10μL)=蓝色噬菌斑数量×稀释因子
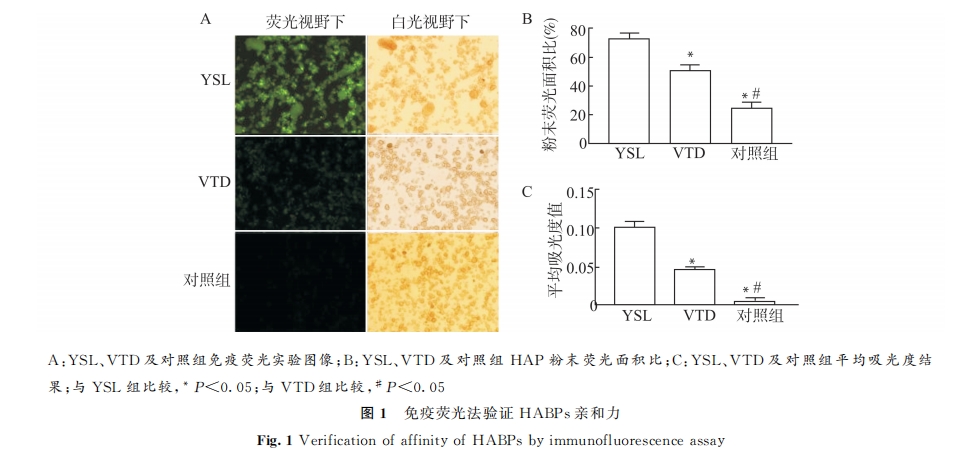
通过免 疫 荧 光 技 术 再 次 验 证 2 种 结 合 肽 与HAP的亲和力。取等量 HAP 粉高压灭菌消毒备用。用异硫氰酸荧光素(fluoresceinisothioc)标 记 的 抗 M13 单 克 隆 抗 体 (RLyanate,ph2,sc-53005FITC)对结合于 HAP 表面的噬菌体进行标定,对 M13噬菌体-HABPs的亲和力进行半定量分析[5]。实验组分别为投入等量的目标肽序列和随机肽序列,以不加任何肽序列作为空白对照组,同时暴露于1mLPBST 缓冲液2h,温和摇床。吸走目标序列组和随机肽序列组未结合的噬菌体后,3组样本同时加入200μLFITC 标记的抗噬菌体外壳蛋白pVⅢ的抗 M13单克隆抗体避光温育1h,最后用新鲜配置的 PBST 缓冲液洗涤5次。依次将等量粉末悬浮液转移到显微镜载玻片上,使用倒置荧光显微镜进行观察,使用ImageJ软件大致计算噬菌体颗粒表面被荧光覆盖面积,将荧光图像中噬菌体的覆盖面积与白光下图像中粉末的近似表面积进行比较[6],得到粉末被荧光点亮的面积比值(荧光视野下的噬菌体覆盖面积/白光视野下的粉末面积)和其平均吸光度(A)值。
1.6 环境pH 值变化对 HABPs解吸附行为的影响
为了测定目标肽序列 YSL与随机肽序列 VTD在不同pH 值 TBST 缓冲液浸泡洗脱1h后的解吸附性能,配制 pH 值为8.5、7.5、6.5、5.5和4.5的TBST 缓冲液(含0.15[V/V]吐温20),依照常规洗脱方案,将底物 HAP 依次使用去离子水、无水乙醇、去离子 水 超 声 振 荡 5 min 后 高 温 高 压 灭 菌 40min,再置于90℃ 10%氢氧化钠溶液中浸泡1h后使用大量去离子水清洗 HAP 至中性,加入10mLpH=8.5TBST 缓冲液中37℃温和摇床过夜,吸取过夜液体加入封闭液1mL,37℃温和摇床封闭1h,吸取封 闭 液 后 使 用 pH=8.5 TBST 缓 冲 液 清 洗HAP数次,分别于管中投入等量2×1010pfu的目标肽序列 YSL及随机肽序列 VTD 单克隆噬菌体,37℃温和摇床进行孵育1h后吸去管中未结合的噬菌体,然后用10mL新鲜配置的pH=8.5TBST 缓冲液清洗多次以去除残余未结合的噬菌体,再换新鲜配置的1150μLpH=7.5TBST 缓冲液浸泡1h后回收全部液体,再依次换用新鲜配置的1150μLpH 为6.5、5.5、4.5的 TBST 缓冲液重复上述操作回收浸泡液,最后再用1150μL 非特异性洗脱液洗脱并回收终末洗脱液。通过滴度测试测得目标肽序列 YSL和随机肽序列 VTD 在这4组pH 值(7.5、6.5、5.5、4.5)TBST 缓冲液浸泡洗脱1h后回收液及终末非特异性洗脱液的滴度结果,实验重复3次。
所有数据以均数±标准差表示,统计分析均使用 GraphPadPrism6.0软件进行。计量资料组间均数比较采用t检验的非配对双侧检验分析均值之间的差异,以P<0.05为差异有统计学意义。
2 结果
从 HAP的 XRD 图结果可得其与羟基磷灰石的(002)、(112)、(300)和(202)晶面的特征吸收峰匹配良好,表明粉末主要物相为羟基磷灰石。
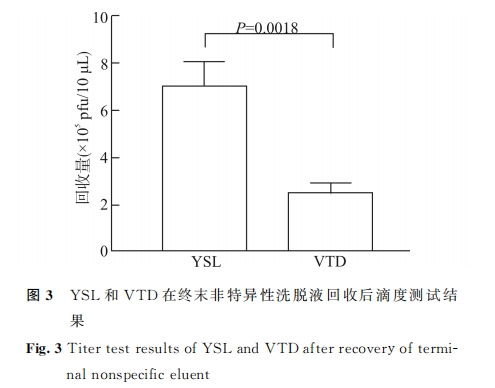
YSL 和 VTD 噬 菌 体 投 入 回 收 比 结 果 显 示,YSL噬菌体回收率为 VTD 噬菌体回收率的 17.5倍,且差异具有统计学意义(P=0.0027),表明 YSL对底物 HAP具有较强结合力。
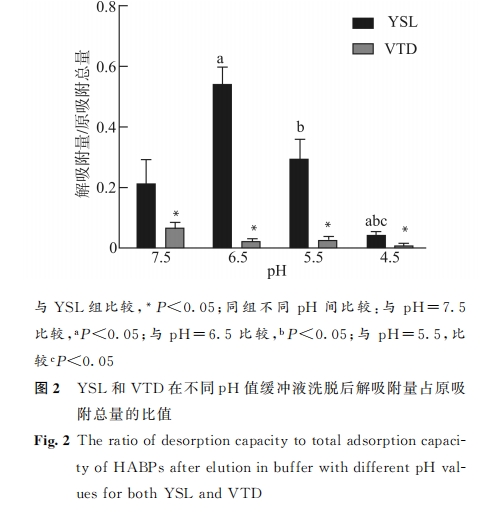
为分析 YSL和 VTD于不同pH 值缓冲液中在HAP表面的解吸附行为,我们对比两者在新鲜配置的pH=7.5、6.5、5.5、4.5TBST 缓冲液中依次浸泡1h 后 各 回 收 液 的 滴 度 测 试 结 果 (图 2),发 现YSL在各pH 值缓冲液中释放的噬菌体数量占原吸附总量的比例均明显高于 VTD(均P<0.05),表明在相同pH 值缓冲液中 YSL较 VTD有明显的解吸附行为。同时我们还注意到,YSL 在不同 pH 值缓冲液洗 脱 下 释 放 的 噬 菌 体 数 量 也 有 差 异 (P<0.05),表明其对生理环境pH 值的改变反应敏感且明显。在pH=6.5缓冲液洗脱下释放的噬菌体数量最多,而后随着缓冲液pH 值降低,回收液中的噬菌体数量逐渐减少。而 VTD 在不同 pH 值缓冲液中释放的噬菌体数量无明显差别。
3 讨论
HAP作为一种重要的生物医学材料,在口腔医学领域有着广泛的应用,因其自身的复杂性使得其与多肽之间的作用机制一直都是该领域的研究难点。随着以噬菌体随机肽库与展示技术为代表的生物文库技术的出现,这一高通量的筛选与平台技术为研究 HAP等生物材料与多肽相互作用的机制提供了可能和便利条件[7]。大部分研究通过噬菌体展示技术获得理想的肽序列之后往往会通过体外合成成品 HABPs进行后续的实验,但人工合成 HABPs往往存在成本高、周期长的问题,而噬菌体展示状态下的肽序列因噬菌体自身可增殖的生物特征可通过扩增的方法不断重复获得,具有成本低且周期短的优势。本研究直接使用通过噬菌体展示技术分离得到的一条对 HAP表面有较强亲和力的新七肽序列YSLHWGE(即 HABPs),通过噬菌体滴度测试和免疫荧光实验鉴定出该序列较随机肽序列与 HAP底物有更强的结合力。再利用不同pH 值的 TBST缓冲液(pH=7.5、6.5、5.5、4.5)作为洗脱液依次浸泡1h,发现目标序列 YSL 较随机肽序列 VTD 更容易受环境pH 值变化发生解吸附行为,具有一定的缓释能力。基于这一系列结果我们尝试探讨该结合肽序列有较高亲和力且具有敏感解吸附特征的原因,以期为深入理解蛋白在 HAP 表面的吸附行为提供参考。
HAP的表面很复杂,目前我们得知 HAP等电点在pH=7左右,整体上偏中性,同时表面带有电荷[8]。而蛋白 质 的 HAP 界 面 吸 附 是 一 个 十 分 普遍、非常复杂而又极其重要的现象,受材料和蛋白质的自身性质以及溶液环境等内外因素综合影响,其主要驱动力包括氢键、静电相互作用、疏水相互作用和范德华力等。除了蛋白质多肽链段上的自由氨基和羧基基团被认为是影响蛋白质界面吸附的主要因素外,蛋白质多肽链段的氨基酸组分和序列也被认为对蛋白质的界面吸附有主导作用[9]。同时有研究表明,吸附体系中 pH 值的改变能够调节 HAP 的表面电荷量,进而改变 HAP 与蛋白质分子之间静电作用的类型和强度[10]。
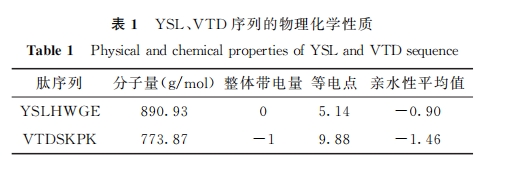
HAP表面有2种不同类型的结合位点,分别为带正电的 C位点(富含钙离子)和带负电的 P 位点(富含磷酸根离子),被认为是蛋白质在 HAP 表面的结合位点并提供蛋白质吸附的主要驱动力;其中蛋白质的羧基基团和氨基基团分别结合带正电荷的C位点和带负电荷的 P位点,C 位点对负电荷的亲和力比 P位点对正电荷的亲和力更强。除此以外,酸性氨基酸基团能够强烈地结合 HAP表面的钙离子,这也是大多数富含 γ-羧基化谷氨酸、聚谷氨酸以及磷酸化氨基酸等酸性氨基酸基团的非胶原类蛋白质或多肽可参与矿化过程的原因[10]。同时,除静电力外,疏水相互作用是诱导蛋白质表面亲和力增加的另一个重要途径。一般来说,疏水表面对蛋白质的吸附作用比中性荷电的亲水表面强,因为蛋白质的两亲结构中存在疏水的残基结构,通过疏水作用使蛋白质倾向于吸附在疏水表面[11]。因此具有疏水性的 HAP 本身对蛋 白 质 就 有 一 定 的 吸 附 能力。而经研究鉴定出来的目标肽序列 YSLHWGE与随机序列 VTD相比较含有酸性氨基酸 Glu(谷氨酸)且位于序列末端,意味着序列末端有2个羧基能与 HAP中 C位点的 Ca2+ 多一个相结合的位点,同时目标肽序列 YSL 其亲水性平均系数(GRAVY)大于随机组 VTD,意味着目标肽序列 YSL 亲水性小于随 机 组 VTD,与 HAP 的 疏 水 作 用 更 强。此外,有报道表明,较大的蛋白质有更多的结合位点与底物表面相互作用[11]。因此,较大的分子有可能被更多地吸附在表面上。所以从分子量对比,YSL 可能比 VTD有更多的结合位点,以上这些都有可能是 YSL较 VTD对 HAP亲和力更强的原因。
生理环 境 是 影 响 蛋 白 质 吸 附 的 重 要 因 素,而pH 值是影响生理环境中电学性能的重要参数。研究表明,pH 值的降低会增加酸性蛋白的吸附。之前很多研究表明在不同 pH 值环境下,HAP 表面Zeta电位均为负电位[12],同时有报道表明,HAP颗粒对 BSA 的吸附能力随 pH 值增大而减弱[10]。原因是随着体系pH 值增大,溶液中 OH- 浓度增大,HAP表面吸附 OH- 逐渐增多;而 BSA 蛋白分子等电点为4.7,在 pH>pI时带负电荷,HAP 与 BSA之间存在静电斥力,使 BSA 分子难以扩散到 HAP微粒表面发生吸附,导致 BSA 在 HAP表面的吸附量逐渐减小。我们研究的 YSL 与 BSA 情况相似,等电点为5.14,所以当用pH 大于pI的 TBST 浸泡1h后,YSL因缓冲液中 OH- 浓度不同程度的增加从而带有不等量的负电荷,与 HAP 存在静电斥力而发生解吸附行为,导致释放在浸泡回收液中噬菌体数目增多。当用pH 值(4.5)小于pI的 TBST 缓冲液浸泡1h时,YSL带有少量正电荷,与 HAP之间发生静电引力,因此对 YSL 的吸附量逐渐增加,此时释放到溶液中的噬菌体数量明显减少。此外,HAP的溶解度也是影响溶液性能的重要参数。研究表明[13],HAP在缓冲液 pH 值降低过程中会伴HAP的溶解,随着酸性加强,H+ 增多,HAP 的溶解量随 之 加 大,大 量 的 羟 基 发 生 脱 离 并 停 留 在HAP附近,加上 Ca2+ 的远游破坏电中性以及磷酸根基团的脱离,使得 HAP表面 Zeta电位仍呈负电性,随着酸性再增加,脱离的羟基、磷酸基团和 Ca2+数量进一步增加,则Zeta负电位绝对值又将有所增大。所以这两方面机制使得吸附于 HAP表面带有目标肽序列 YSL 的噬菌体数量随着 pH 值降低而减少。
因此,我们可以利用这种解吸附特征随生理环境pH 值改变的 HABPs序列与某些抗菌物质相结合用作口腔植入物的表面涂层,在口腔唾液因进食等生理活动变化导致pH 值改变时可释放该抗菌复合物,起到控制菌斑的效果,这将具有一定的临床应用前景。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志