
摘要 线粒体(mitochondrion)是真核生物细胞中的一种非常重要的细胞器,含有独立于细胞核染色体外的遗传物质,通过氧化磷酸化产生 ATP,是细胞的能量工厂,与细胞分化、信号转导、代谢稳态等过程密切联系。线粒体功能的紊乱与癌症、神经退行性疾病、糖尿病等许多疾病的发生、发展及治疗息息相关。线粒体在细胞命运中扮演的关键角色,使对线粒体这一特殊细胞器的探索成为生命科学研究热点之一。人线粒体 DNA(mitochondrial DNA, mtDNA)是一相对保守且仅 16 kb 的环状双链 DNA 分子,只含 37 个基因,但这些基因都是维持线粒体功能稳定必不可少的部分。随着对线粒体功能认识的不断深入,研究人员发现 mtDNA 突变,会导致活性氧自由基过量产生,从而引起细胞衰老,甚至引发诸多疾病,例如遗传性视神经病变、线粒体脑肌病伴高乳酸血症和卒中样发作综合征等。但是,目前针对这些线粒体基因疾病尚无非常有效的治疗手段。为了进一步了解这一关键细胞器,研究人员开发了一些有效的方法来突破线粒体的复杂屏障。本文将重点介绍并讨论近几年靶向 mtDNA 的研究进展,主要从药物修饰、材料递送、基因编辑等方面进行了总结,希望能为推动线粒体的研究提供一些新的思路。
1 线粒体及线粒体 DNA
线粒体是一种广泛存在于大多数真核细胞内的细胞器,通过氧化磷酸化产生 ATP,是细胞中的能量工厂。线粒体参与细胞分化、细胞信号传递和细胞凋亡等过程,拥有调控细胞生长和细胞周期的能力,在钙稳态调节、三羧酸循环、脂肪酸氧化、氨基酸代谢、氧化还原信号传导等许多细胞活动中发挥重要作用[1-2]。这种独特的细胞器由两层膜组成:多孔的外膜及高度内皱的内膜。外膜较光滑,发挥细胞器界膜的作用;内膜由高密度饱和磷脂组成,相比细胞膜及线粒体外膜的蛋白质脂肪比(1 ∶1),线粒体内膜具有更高的比例(3 ∶1)[3]。并且,线粒体具有的高膜电位(Δψm 约为-180 mV),是线粒体功能状态的重要参数之一。线粒体膜电位降低是细胞凋亡的早期预警。双层膜结构及膜电位等这些线粒体生理特性,使物质穿透这两层膜需要不同的转运载体。有效排除大部分离子和分子的渗透,正是这种高度排他性保证了氧化还原所需质子梯度的稳态环境[4]。
线粒体是一种半自主细胞器,拥有独立于核基因存在的遗传物质线粒体 DNA(mitochondrial DNA,mtDNA)。一般每个线粒体中含有多组 mtDNA,不同物种的线粒体基因组大小不一。人 mtDNA 为长约 16 kb 的环状双链 DNA 分子,编码了 22 种 tRNA、2 种 rRNA 和 13 种线粒体氧化磷酸化相关的蛋白质(多肽),有重链(H)和轻链(L)之分,其中重链富含嘌呤, 轻链则以嘧啶为主[5]。与核基因组相比,mtDNA 分子量小,游离在高氧化还原的线粒体基质环境中,易因活性氧( reactive oxygen species,ROS)而受到损伤,又缺乏组蛋白的保护,因而,mtDNA 的突变率比核 DNA 高 10 ~ 20 倍[6,7]。mtDNA 具有高效复制性,主要通过碱基切除途径修复,且自身修复系统相对单一低效,mtDNA 的准确复制和修复对细胞存活和繁殖至关重要[8,9]。
线粒体功能紊乱与神经退行性疾病、心血管疾病、呼吸系统疾病、消化系统疾病、肥胖和癌症等都有着密不可分的联系[10, 11]。相较于正常细胞,许多癌细胞的线粒体膜电位更高,活性氧浓度异常增加,这些差异为选择性靶向癌细胞提供了基础。同时,许多导致细胞凋亡的信号通路都聚集在线粒体中,通过改变线粒体的功能,可达到破坏这一能量工厂的效果。mtDNA 具有的裸露开放性和低效修复性,使其更易与抗癌药物结合,导致 mtDNA 损伤,影响线粒体的功能,从而改变细胞的生存状态。因此,将现有药物进行线粒体靶向性修饰,以期通过损伤线体这一重要细胞器来诱发细胞死亡成为了近年来炙手可热的研究方向[12]。
本文将着重讨论几种针对线粒体 DNA 的化学修饰药物方法、药物递送材料以及基因编辑等手段的研究现状。
2 线粒体靶向策略
线粒体的双层膜结构使许多分子难以进入该细胞器。为了突破这道屏障,蛋白质与核基因编码的线粒体靶向多肽序列 ( mitochondrial targeting sequence, MTS)连接,通过 TIM / TOM 复合物等膜通道定向转运进入线粒体[4]。这段可切割的线粒体靶向信号多肽一般位于蛋白质 N 段,由 20 ~ 40 个带正电荷的疏水氨基酸组成。目前,利用这一转运机器,可将许多蛋白质递送到线粒体并进行研究,例如限制性核酸内切酶、超氧化物歧化酶和凋亡诱导蛋白质等。但该方法仍难以克服例如因MTS 的疏水性导致的蛋白质异常折叠问题、转运机制缺陷等问题。
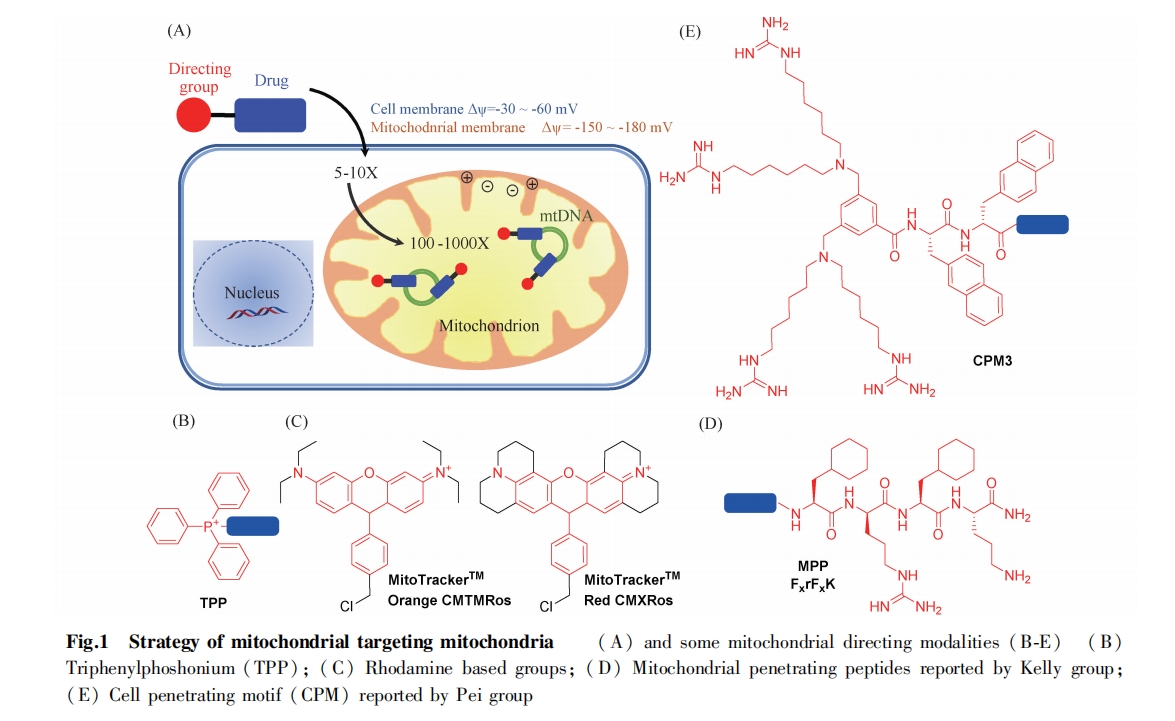
这些小分子靶向定位基团的发现,极大地推动了线粒体靶向药物的研究。然而,目前报道的大部分线粒体定位基团聚焦在线粒体内膜中。开发新的线粒体定位基团,使其靶向线粒体其他部位有助于对线粒体更进一步的了解。
3 药物修饰
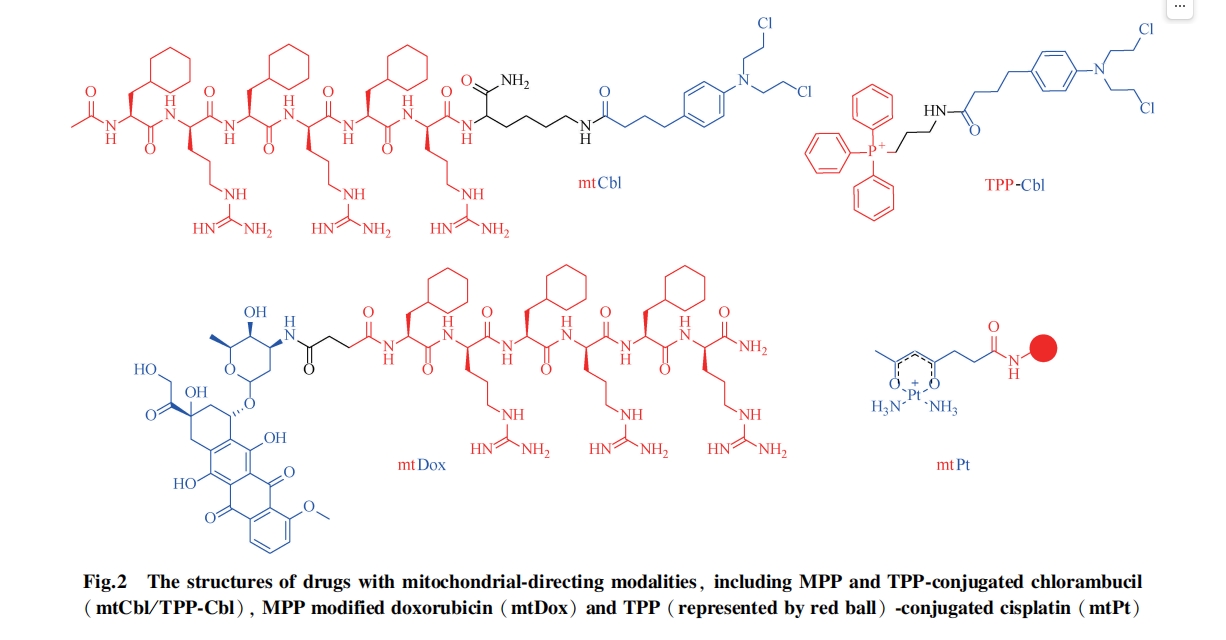
破坏癌细胞核内基因是化疗药物的作用机制之一。然而,癌细胞分裂增殖速度比正常细胞快,且极易产生药物抗性,导致药物失效。线粒体,类似于细胞核,同样拥有自身的遗传物质。因此,研究人员逐渐将目标转向带有 DNA 的线粒体,通过靶向修饰将药物富集于线粒体,破坏 mtDNA,从而导致癌细胞的快速凋亡。将药物与线粒体定位基团缀合形成复合物,将抗癌化合物递送到线粒体基质。在线粒体中,药物浓度迅速达 100 ~ 500 倍,从而有效作用于mtDNA,是现有最普遍并实用的方法。
4 纳米材料递送
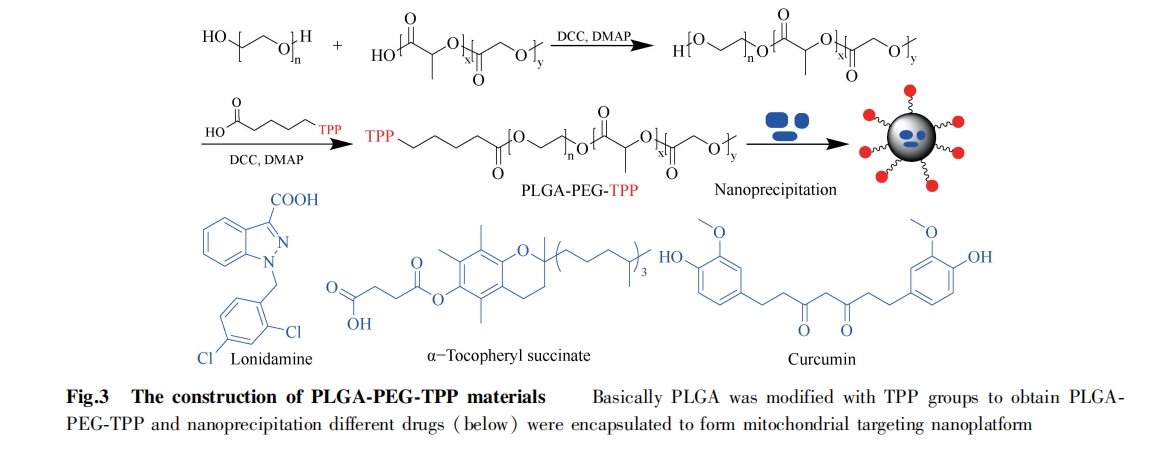
目前,除了 PLGA,已经开发了许多应用于靶向线粒体药物递送的纳米载体,包括石墨烯和纳米胶束等。主要原理是药物通过吸附或共价连接到载体上,载体表面进行线粒体靶向修饰,实现将药物直接靶向至线粒体,并发挥更好的疗效。然而,很多纳米递送材料的生物安全性、生物相容性和生物降解性仍有待优化[27-29]。
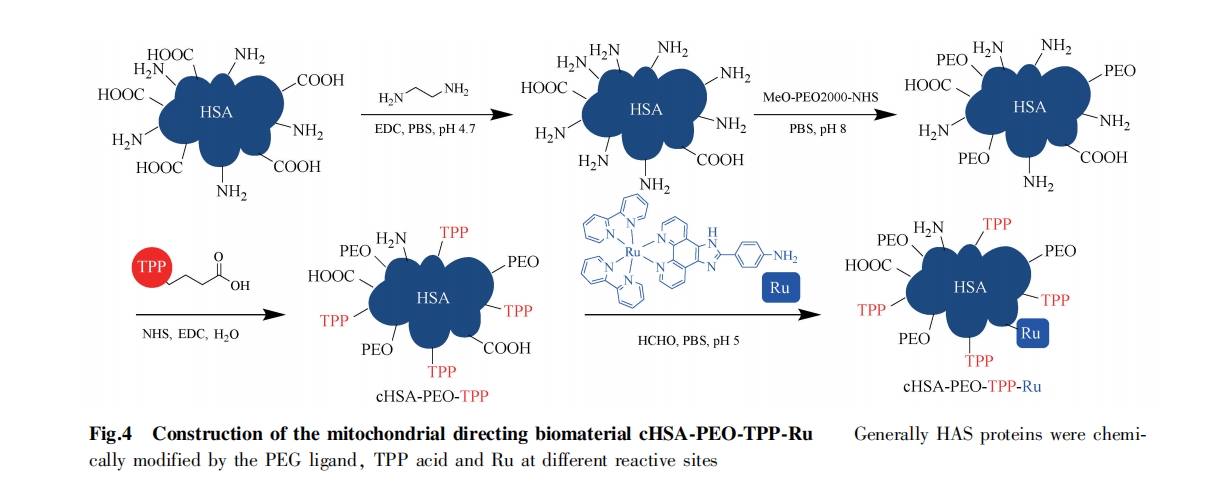
新加坡国立大学 Yao SQ 课题组设计合成了一种可降解的硅纳米粒子。纳米粒子由含有二硫键单体构建,可在胞内谷胱甘肽的作用下发生断裂降解,从而释放粒子内包裹的生物大分子。该方法有效递送抗体、蛋白质、siRNA 等生物大分子,为线粒体药物的开发提供新策略[32, 33]。
5 基因编辑
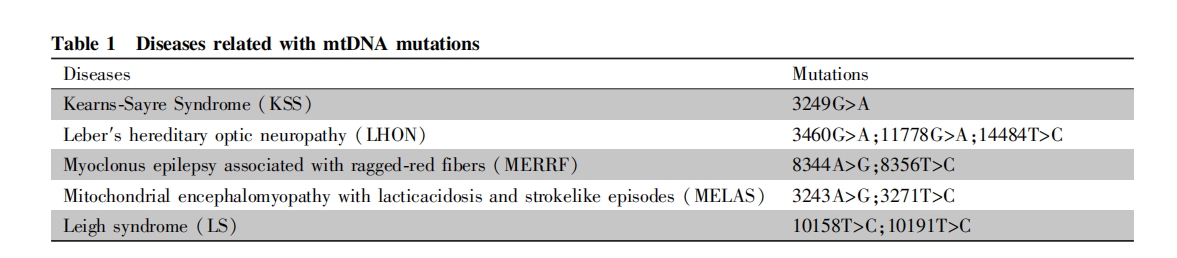
目前,基因编辑技术已从最初细胞自然发生的同源重组,发展到几乎可在任意位点进行靶向切割,为治疗 mtDNA 突变引起的线粒体疾病带来了曙光。2013 年,美国迈阿密大学的 Carlos T. Moraes 及其同仁,将转录激活因子样效应物核酸酶 TALEN(mitochondrial-targeted TALEN, MitoTALEN) 编辑工具引入到线粒体定位靶向序列,使其在翻译后定位转运到线粒体,对 m.5024C>T 突变位点靶向结合并切割,使得突变的 mtDNA 断裂降解[36]。以这种方式处理后,注射到携带突变小鼠中。6 个月后,小鼠肌肉组织 mtDNA 突变率下降 50%,大部分突变基因被清除。同时,英国剑桥大学 M. Minczuk 课题组,同样利用腺相关病毒(AAV9. 45) 将含有线粒体定位的锌 指 核 酸 酶 ( mitochondrially targeted zinc-fingernuclease, mtZFN,另一种基因编辑方式)转运入线粒体,并成功将心,血管组织中的 mtDNA 突变率降低了约 40%[37]。最近,CRISPR 基因编辑技术对细胞核 DNA 编辑方面取得了快速进展。该技术的易设计、便操作、高效率等优点使它成功运用在许多生物学领域。然而,线粒体的双层膜结构使得高负电性的向导 RNA( gRNA)难以进入线粒体基质,同时线粒体内部 DNA 修复机制并不成熟,阻碍了 CRISPR基因编辑技术在 mtDNA 中的应用[38-40]。近期,中国科学院重庆绿色智能技术研究院裴得胜课题组,利用 CRISPR/ Cas9 系统将双链 DNA 插入了斑马鱼线粒体基因组,实现了插入后的线粒体基因的 F0 到F1 的传递,这也为针对 mtDNA 的基因编辑带来了曙光[41]。近期,Broad 研究所 David Liu 团队和华盛顿大学 Mougous 团队,开发利用了伯克霍尔德氏菌(Burkholderia cenocepacia)产生的酶,衍生了不依赖于 CRISPR 系统的线粒体碱基编辑器,显著减少了携带 mtDNA 突变的比例[42]。虽然基因编辑技术距离临床应用仍有很长的路,但为开发针对 mtDNA 疾病的基因疗法提供了非常有潜力的工具。
此外,RNA 干扰技术,例如小型干扰 RNA、小发夹 shRNA 等,通过阻碍特定基因的转录或翻译抑制基因的表达,目前已有 10 个 RNA 药物批准上市,且有超过 50 个 RNA 药物处于临床试验中,这种技术已然成为研究基因功能的强大工具[43,44]。2020 年,加州大学圣地亚哥分校付向东及中国科学院生物物理研究所张晓荣课题组,共同报道了利用体外 RNA导入,Clickin 技术将 siRNA 导入线粒体中,系统地研究了该技术对 13 个 mtRNA 编码蛋白质转录影响,初 步 证 实 了 线 粒 体 内 部 RNAi 干 扰 的 可 能性[45]。同时,也有研究表明,线粒体中存在一些小RNA 和 RNA 的修饰,这也为疾病的疗法提供了新的手段和靶点[46, 47]。
6 问题与展望
线粒体是细胞内独特的细胞器,参与细胞能量代谢、凋亡等许多重要的生命活动。线粒体由于自身含有遗传物质 mtDNA,将核 DNA 药物递送至线粒体,并通过结合 mtDNA,这一过程具有强大应用潜力。目前,线粒体靶向药物研究领域取得了一定的进展,但由于线粒体 mtDNA 的特性,对线粒体疾病的基因治疗要比核基因更复杂,更具有挑战性。相信随着交叉研究的不断深入,对线粒体的功能了解必定会拓宽生命健康领域的发展,为病症开发提供更有效、更安全的治疗方法[48-50]。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志