
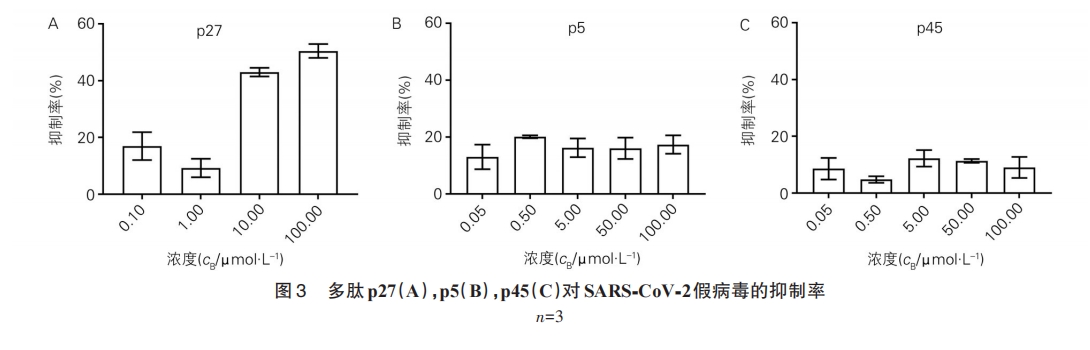
[摘要] 目的 以新型冠状病毒(SARS⁃CoV⁃2)刺突蛋白(S1蛋白)为靶点,筛选抗新冠病毒的多肽类药物。方法以S1蛋白为靶蛋白,利用噬菌体展示技术,从噬菌体随机12肽库中筛选亲和多肽,通过酶联免疫吸附实验(ELISA)验证筛选多肽与靶蛋白的亲和性,并对筛选出的亲和多肽进行细胞水平验证。结果 多肽p27与S1蛋白具有较强亲和性,并有阻止SARS⁃CoV⁃2假病毒进入细胞的作用,IC50为73 μmol/L。结论 多肽p27可能有抗SARS⁃CoV⁃2活性,具有开发成抗新冠病毒多肽类药物的潜力。
新型冠状病毒(SARS⁃CoV⁃2)的出现和迅速蔓延严重损害了人类健康并正在破坏全球经济。SARS⁃CoV⁃2迄今已感染一亿多人,造成300多万人死亡[1],世界大部分地区采取封控模式来阻止病毒的传播,造成了巨大经济损失[2,3]。
文献报道,血管紧张素转换酶 2(angiotensinconverting enzyme 2,ACE2)是新冠病毒进入细胞的受体[4]。病毒表面的刺突蛋白(spike protein,S 蛋白)在膜渗透和感染机制中起到关键作用。S 蛋白由 S1 和 S2 两部分构成,S1 是与受体 ACE2 结合部分[5,6],是新冠病毒进入宿主细胞导致病毒感染和发病的重要决定因素。
噬菌体展示技术(phage display technique,PDT),是一种随机筛选技术[7,8],它使大量的随机多肽与其DNA 编码序列建立直接联系[9],在噬菌体颗粒表面快速生成数十亿个极高多样性肽,可针对靶分子进行迭代筛选[10]。该技术在多肽药物研究领域有巨大应用前景。
为获得抗新冠病毒的多肽类药物,本研究以新冠病毒S1蛋白为靶蛋白,利用PDT,经过3轮筛选和富集,获得与靶蛋白具有亲和性的候选结合肽,应用酶联免疫吸附实验(enzyme linked immunosorbentassay,ELISA)验证多肽与靶蛋白亲和性,并在细胞水平上进一步验证其阻止 SARS⁃CoV⁃2假病毒进入细胞的效果,从而得到与新冠病毒S1蛋白有较高亲和性并有可能抗SARS⁃CoV⁃2活性的多肽,为以S1蛋白为作用靶点的抗新冠药物研究提供新的方向,并发现具有抗 SARS ⁃CoV ⁃2 的多肽类药物的先导化合物。
1 材料与方法
噬 菌 体 随 机 表 面 展 示 12 肽 库(美 国 NEWENGLAND BioLabs公司);SARS ⁃CoV ⁃2 Spike S1⁃HisRecombiant Protein(40591⁃V08H)、M13 BacteriophageAntibody(HRP)(11973 ⁃ MM05T ⁃ H)、SARS ⁃ CoV ⁃ 2Spike antibody(40150⁃D001)(均北京义翘神州科技有限公司);异丙基⁃β⁃D⁃硫代半乳糖苷(isopropyl⁃beta ⁃D ⁃thiogalactopyranoside,IPTG,1122GR005)、5⁃溴⁃4⁃氯⁃3⁃吲哚⁃ β⁃D⁃半乳糖苷(5⁃bromo⁃4⁃chloro⁃3⁃indolyl β⁃D⁃galactopyranoside,XGal,1100GR001)(均广州赛国生物科技有限公司);3,3′,5,5′⁃四甲基联苯胺显色液(3,3′,5,5′⁃tetramethylbenzidine,TMB,P0209,碧 云 天 生 物 技 术 有 限 公 司);HEK ⁃ 293TACE2 过表达细胞株(41107ES03)、COVID⁃19⁃SpikeProtein Pseudovirus(11906ES70)、萤火虫荧光素酶报告基因检测剂盒(1140ES80)(均翌圣生物科技有限公司);细胞增殖毒性检测试剂盒(Cell Counting Kit⁃8,CCK⁃8,CK04,日本同仁化学研究所)。
1.2 方法
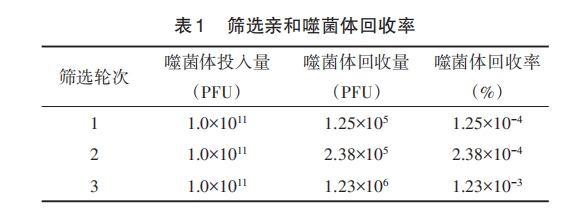
1.2.1 噬菌体随机 12 肽库筛选亲和性多肽 以SARS⁃CoV⁃2 S1 蛋白为靶蛋白,利用噬菌体随机 12肽库筛选亲和性多肽,将 S1 蛋白用包被液稀释至100 μg/ml,包被于 ELISA 板上,4℃湿盒孵育过夜。弃包被液,加 5 mg/ml 牛血清白蛋白(BSA)封闭液,37℃封闭 1 h。用 Tris 盐酸缓冲液+吐温⁃20(TrisBuffered Saline with Tween⁃20,TBST)洗涤后,加噬菌体原库 1×1011 PFU,室温摇育 1 h。用 TBST 洗涤后加非特异性洗脱缓冲液(甘氨酸⁃盐酸),用 pH 9.1Tris⁃HCl 中和,收集洗脱液。取 5 μl 洗脱液测定滴度,剩余扩增、纯化,用于下一轮筛选,共进行 3 轮筛选。
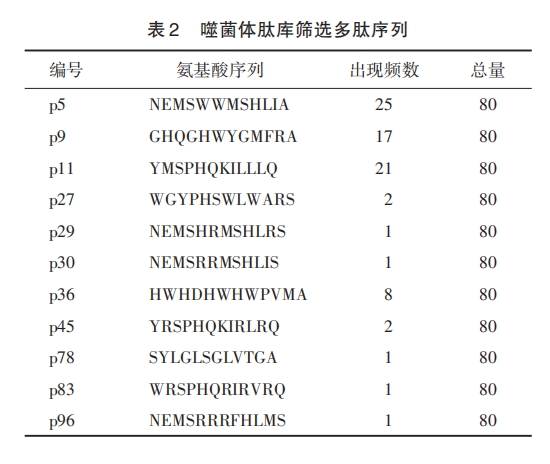
1.2.2 ELISA 验证筛选噬菌体单克隆与 S1 蛋白结合的亲和性 将筛选到的噬菌体上清梯度稀释,采用双层琼脂法,平铺于 IPTG/Xgal 固体培养基上,从接近 100个噬菌斑的平板上挑取 80个噬菌体蓝斑,分别扩增;扩增后噬菌体上清一半用于无水乙醇法快速提取 DNA,送公司测序;剩余测定滴度用于ELISA验证。样品孔包被S1蛋白,BSA为空白孔,置4℃湿盒中过夜。次日,弃包被液,加 BSA 稀释液37℃封闭1 h,拍掉闭液,加相同浓度噬菌体上清,室温摇育 1 h,弃噬菌体,用 TBST 洗板 6 次后,加抗M13 抗体稀释液,摇育 1 h,TBST 洗板 6 次,加 TMB显色液,室温 20 min,加终止液,酶标仪检测 450 nm处光密度(D450)值。
1.2.3 筛选亲和多肽的合成 测序得到 DNA 序列后推导出氨基酸序列,根据多肽的氨基酸序列,合成带有生物素标记的多肽。
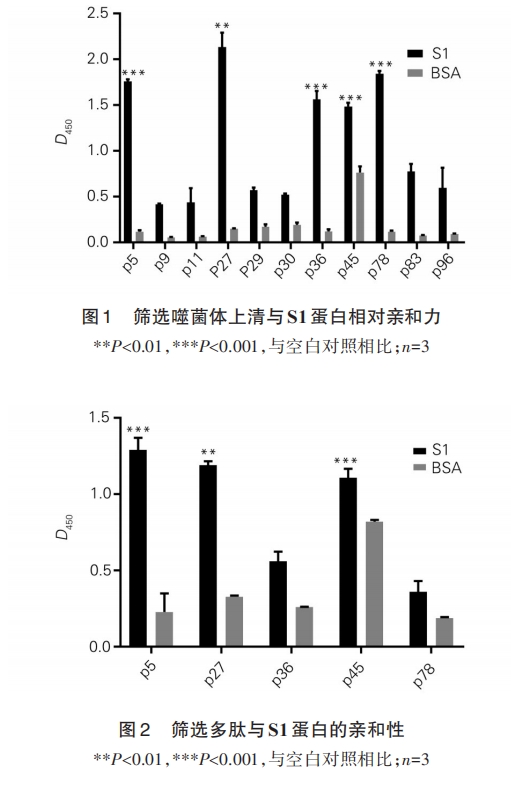
1.2.4 ELISA 验证筛选多肽与 S1 蛋白结合特异性 用包被液稀释链霉亲和素 10 μg/ml,包被于ELISA 板上,4℃湿盒中孵育过夜。拍掉包被液,加5 mg/ml BSA,0.1 μg/ml链霉亲和素封闭液,4℃封闭1 h;加筛选结合肽,室温摇育 1 h;用 TBST 洗涤后,加S1蛋白,作用1 h;用TBST洗涤后,加抗S1蛋白小鼠源抗体,室温摇育 1 h,TBST 洗涤后,加入 HRP 标记的抗小鼠抗体,室温作用 1 h;TBST 洗涤后,加入TMB 显色液,室温反应 15 min,加终止液,酶标仪检测450 nm处光密度(D450)值。
1.2.6 细胞毒性实验 取对数生长期 HEK⁃293T⁃ACE2细胞,以1×104细胞/孔密度铺于96孔板,37℃、5%CO2培养 18 h。将梯度稀释多肽 p27 加入细胞中,继续培养 48 h 后,加 CCK⁃8 试剂,37℃继续培养40 min,酶标仪测D450值。
采用 GraphPad Prism 7 软件进行统计学分析,数据以xˉ±s 描述,计算出IC50值,采用t检验以及单因素方差分析,Dunnett⁃t进行两两比较,P<0.05代表差异具有统计学意义。
2 结果
3 讨论
SARS⁃CoV⁃2 S1蛋白可通过与靶细胞受体ACE2结合介导病毒侵入过程,是病毒治疗药物和疫苗研究的关键靶点。本研究以 S1 蛋白为靶蛋白,通过PDT,筛选与靶蛋白具有亲和性的结合肽,通过ELISA验证结合肽与S1蛋白的亲和性[11,12],发现p27、p5和p45 与 S1 蛋白有较强的亲和性。SARS⁃CoV⁃2 假病毒是将慢病毒载体中的包膜糖蛋白用新冠病毒 S蛋白替代,可形成模拟新冠病毒感染的假病毒[13]。假病毒通过表面 S 蛋白感染 HEK⁃239T⁃ACE2 细胞并表达报告荧光素酶基因。结果显示,p27 可阻止新冠病毒S蛋白假病毒进入HEK⁃239T⁃ACE2细胞,提示结合肽p27可能会阻断S1蛋白与ACE2受体的结合,但尚不能确定其在阻止 S1 蛋白与 ACE2 受体结合中的作用如何。后续将深入探究p27能否阻止S1 蛋白与 ACE2 受体的结合,并对其作用机制及体内外抗SARS⁃CoV⁃2的活性进行研究。同时,以p27作为先导化合物,对其进一步修饰优化,以提高抗病毒活性。后续可探索 p27 对 SARS⁃CoV⁃2 病毒的抑制作用,研发抗新冠病毒的多肽类药物。另外,对于筛选的p45、p5结合肽可作为靶向性载体,递送其他具有抗 SARS⁃CoV⁃2 的药物,提高药物靶向性及生物利用度。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志