
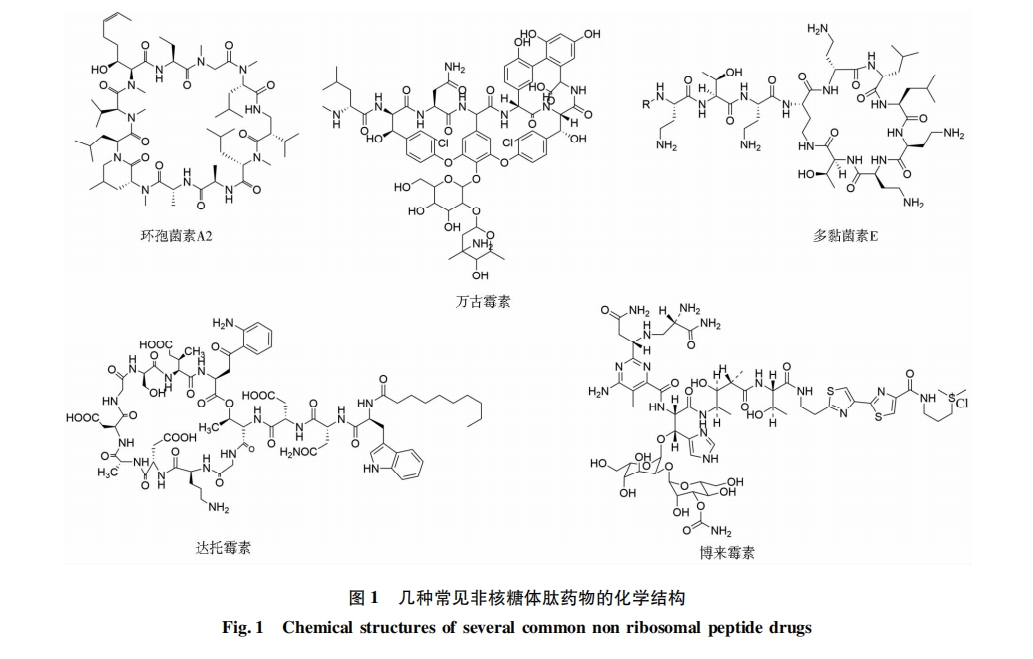
摘要:天然次级代谢产物是重要的药物来源,非核糖体肽(non-ribosomal peptide,NRP)是自然界中广泛存在的次级代谢产物,其多样的化学结构使其具有多种生物活性,如抗炎、抗肿瘤、抗病毒等。基于非核糖体多肽合成酶(nonribosomal peptide synthetases,NRPS)模块化线性合成多肽的原理对其催化模块进行改造、重组,定向设计多肽的生物合成途径以获得目的多肽已成为一个研究热点。然而杂合NRPS存在催化模块无法加载目标氨基酸或多肽合成效率显著降低等诸多问题,限制了其应用。近年来,NRPS腺苷酰化域(adenylation domain,A域)及缩合结构域(condensation domain,C域)的底物选择性、NRPS亚基间对接域(docking domain,DD)和模块间连接区(linker)的研究已取得较大突破。从C域对底物的选择性及以不同融合边界进行催化单元替换两方面进行综述,介绍NRPS催化模块重构的研究进展,并概述了各替换方案的优点与局限性。
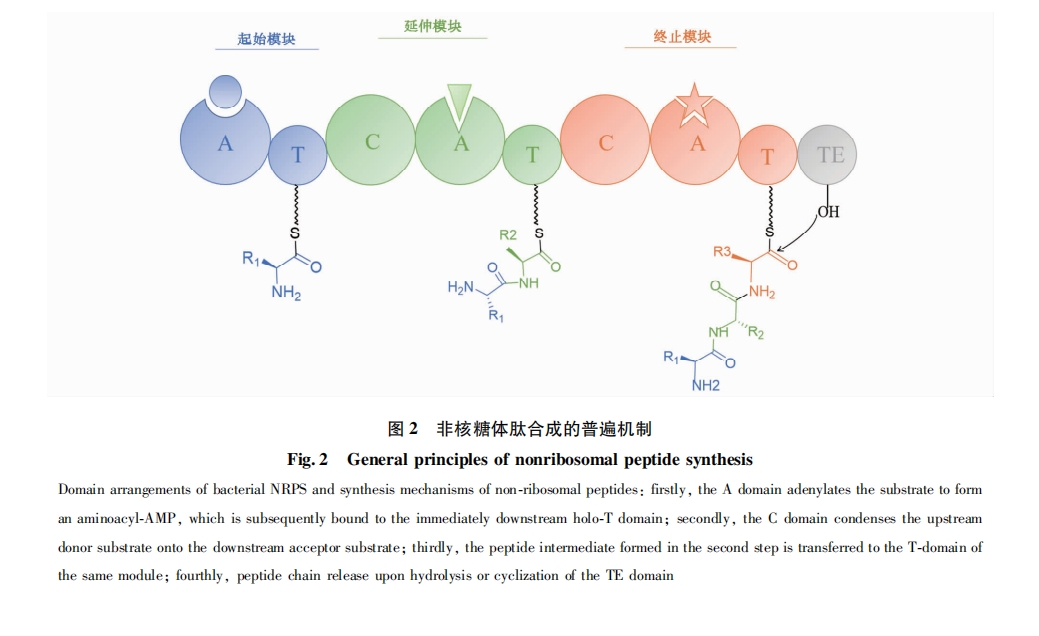
基于NRPS线性合成机制和模块化原理,人们一直尝试采用组合生物合成的方法对编码非核糖体肽合成酶的催化单元进行操作[15],以亚基交换[16]或模块/结构域交换[17]/增加[18]/减少[19]等方式改变原有非核糖体肽的生物合成途径,获得新的非核糖体肽类化合物或其衍生物。但是前期的研究数据表明随机寻找NRPS结构域边界间的蛋白质同源区域进行模块交换的成功率并不高:一方面,按一般规律进行模块交换和杂合,往往导致目标产物产量的急剧下降;另一方面,合适的交换边界仅在蛋白质序列同源性较高的NRPS之间较易寻找,具有一定局限性[17]。近年来,NRPS催化模块重构研究取得了较大的突破,我们在下文中对相关进展进行了重点论述。
1 模块替换
对NRPS进行改造主要有两个难点:其一是酶对底物变化的容忍度;其二是在功能域之间重组拼装过程中,融合边界对蛋白质整体结构产生了影响从而降低了酶活。因此要使杂合NRPS可识别加载底物合成目的多肽及提高杂合NRPS的催化效率,关键在于提高杂合模块对底物的选择性以及将嵌入蛋白对整体蛋白质空间结构的影响减至最小。我们认为至少需要考虑三方面的问题:一是杂合模块来源的选择。对应同一氨基酸残基融合不同NRPS来源的功能模块催化效率是否有差异。二是杂合边界的选择。可以根据蛋白质序列的保守性判断每一个结构域的边界,通过原始模块与替换模块间蛋白质序列的比对在结构域连接区域寻找同源性较高的序列作为边界节点进行替换。三是考虑缩合域的底物特异性。虽然腺苷酰化A域是底物氨基酸选择的第一道门槛,但是催化模块中的缩合结构域C域对底物也有选择特异性。往往在对NRPS的A结构进行替换后,腺苷酰基化的氨基酸不能在C域进行缩合反应而使肽链无法延伸,且C域对其相邻下游A域的底物选择性产生影响。
在非核糖体肽装配过程中,首先由腺苷酰化域从可利用的氨基酸底物池中选择相对应的特异氨基酸合成相应的氨酰-AMP[9]。许多研究表明,NRPS每一催化模块延伸氨基酸的特异性主要取决于A域和C域,其中A域是底物氨基酸选择的第一道门槛。A域腺苷酰化氨基酸底物的特异性导致催化模块延伸氨基酸残基的差异。因此,最早的模块替换集中在A域。Stachelhaus等[20]于1995年在枯草芽孢杆菌(Bacillus subtilis)中用异源A域替换脂肽抗生素Surfactin合成酶SrfA-C中Leu7特异性A域(SrfA-A7),成功得到了Phe7、Orn7、Cys7、Val7取代的系列Surfactin类似物 (图3a)。随后,该团队继续用异源AT域替换合成酶SrfA-A中Leu2特异性A域(SrfA-A2),得到了Orn2取代的Surfactin类似物[21]。虽然上述A域及AT域替换均得到了目的产物,但该实验中Surfactin类似物的产量均明显下降。此外,并不是所有的A域替换均能获得预期产物。例如,Ackerley和Lamont[22]分别采用异源的腺苷酰化L-Thr、Cys、Val和Ser的A域替换铜绿假单胞菌(Pseudomonas aeruginosa PAO1)非核糖体肽合成酶第4个亚基PvdD模块一的A域(L-Thr),仅腺苷酰化L-Thr的A域替换有少量产物pyoverdine产生,其余杂合的NRPS均无功能 (图3b)。此实验中非Thr特异性腺苷酰化域替换后无多肽产物合成可能是由于C域的底物特异性。1999年Belshaw等[23]在对C域研究后提出假想,C域的C端部分为受体位点,结合氨酰-S-PCP;N端部分为供体位点,结合上游的肽基-S-PCP,受体位点对受体底物氨酰-S-PCP有强选择性,供体位点对供体底物侧链氨基酸仅有弱选择性。因此杂合A域识别的Cys、Val和Ser无法进入上游C域结构,进而无法与上游肽链缩合,导致肽链延伸中断[22]。然而Belshaw等研究的不足之处在于仅以一个氨基酸即氨酰-S-PCP作供体底物,无法证明C域供体位点对多肽的选择性,当供体底物为肽-S-PCP时,供体位点选择性并非如此[24]。
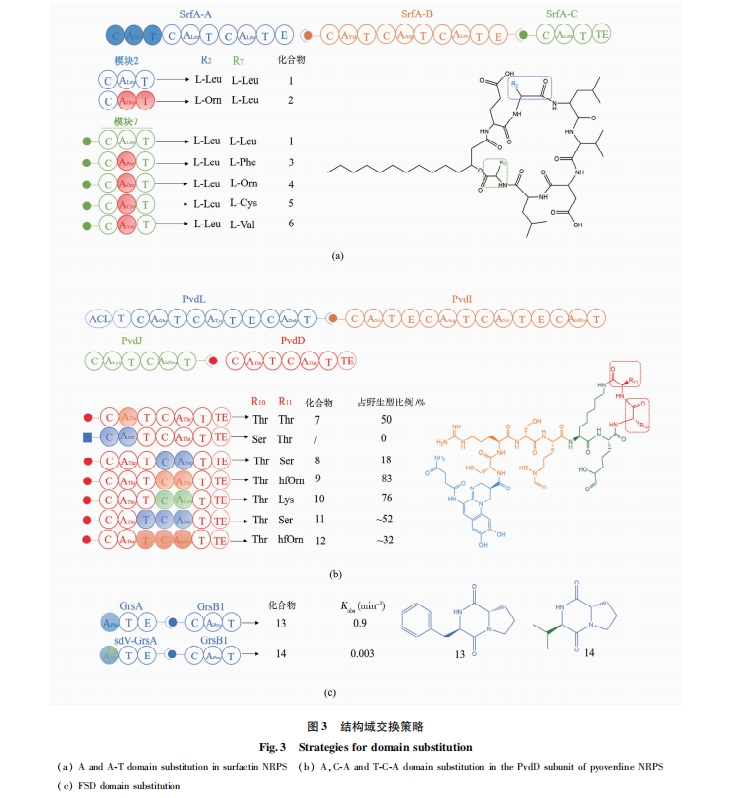
如前述,A域从氨基酸底物池中选择相对应的特异氨基酸合成相应的氨酰-AMP。有报道显示,A结构域中有10个非连续编码的关键氨基酸残基决定了其底物识别的特异性[25]。因此,除完整的A域替换外,近年来有研究尝试替换A域内包含关键活性氨基酸残基的高度保守的一个黄素氧还蛋白样亚域(flavodoxin-like sub domain,FSD)[26-27]。交换FSD能最小地破坏A域的整体结构,维持和其它结构域间的关键相互作用,使杂合的NRPS保持原有催化效率[26]。例如,Kries等[27]用9个不同底物特异性的FSD替换对苯丙氨酸特异性识别的gramicidin S合成酶起始模块GrsA的FSD。其中,替换缬氨酸特异性FSD的GrsA腺苷酰化活性强。并且在添加脯氨酸特异性GrsB1模块后,GrsA- GrsB1作为一个Val-Pro二酮哌嗪合成酶发挥作用,合成了D-Val-L-Pro二酮哌嗪 (图3c)。Thong等[28]用CRISPR-Cas9基因编辑技术,替换enduracidin合成酶的FSD,得到了一系列新的脂肽,有的产量接近野生型菌株。
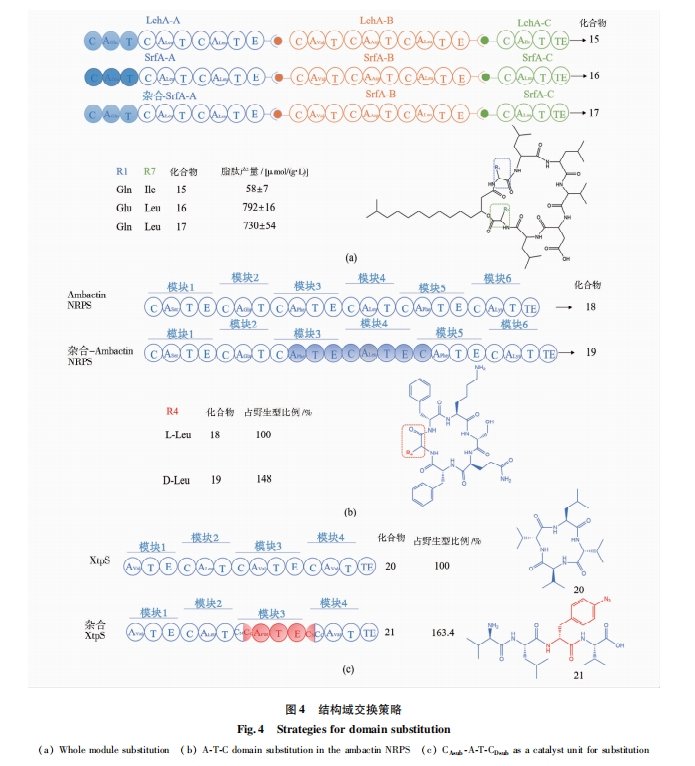
在NRPS中采用模块整体替换能够保证催化单元模块结构和功能的完整性。例如,用脂肽lichenysin生物合成基因簇中的Gln识别模块CAT交换surfactin合成基因簇中的Glu模块,得到了高产、高活性的新型脂肽[29](图4a)。用达托霉素NRPS中模块11CASerT交换模块8 CAAlaT,得到8号位D-Ser取代的达托霉素类似物;用模块8 CAAlaT替换模块11 CASerT,得到11号位D-Ala取代的达托霉素类似物[17]。这两种新化合物均对金黄色葡萄球菌具有药理活性,但产量仅为野生型菌株的15%和45%左右。有研究以T-C域间的LGG(H/D)S(I/L)保守序列为融合位点,将一个钙离子依赖的脂肽抗生素(calcium dependent antibiotic,CDA)合成酶模块13 CATrpT和A54145 NRPS模块13 CAIleT替换达托霉素NRPS模块13CAKynT,分别获得了13位Trp和Ile取代的达托霉素类似物,且对杂合NRPS催化效率影响较小,新化合物产量最高接近原产量的67%[30]。
在1.1所述异源A域替换PvdD模块一L-Thr A域的同时, Ackerley和Lamont[22]用异源CA域(包括L-苏氨酸特异的CA域)替换PvdD模块一CA域,但意外的是所有杂合酶均无活性。CA域交换失败的原因有:(1)杂合的异源CA域无法与PvdD模块一的天然T域有效互作,导致杂合酶无活性;(2)现有理论显示,亚基间的对接域可指导非核糖体肽合成酶正确的线性排列,并介导亚基间的互作,该实验中PvdD模块一的CA域替换后无法与上游亚基PvdJ正确对接[31⇓-33](图3b)。
Tanovic等[34]在对枯草芽孢杆菌中的脂肽抗生素合成酶最末端模块SrfA-C的结构研究后发现,其缩合域(C域)和腺苷酰化域(A域)之间有一段含32个氨基酸的连接区,在SrfA-C晶体结构中,该连接区与C域、A域均紧密相连。因此,人们认为在模块替换时需保持CA域结构完整,C域与A域应作为不可分割的整体才能避免破坏杂合酶的结构和活性。基于此现象,Calcott等[35]继续用异源CA域替换PvdD亚基第二个模块CA域。与该团队早期替换PvdD亚基第一个模块CA域不同,替换PvdD亚基第二个模块CA域可避免破坏PvdD与上游亚基PvdJ间的相互作用(图3b)。结果显示,有两个杂合NRPS具有较好的催化活性,并获得了两种Thr11和Lys11取代的pyoverdine类似物,产量分别是野生型的83% 和76%,其余6个杂合酶均无活性[35]。
2 融合边界
在初期研究中,从保证模块功能完整性的角度考虑,研究者通常以A结构域或一个完整的CAT(E)模块单元对NRPS进行替换等改造[27-28,36]。例如,以T-C域间连接区为融合边界替换达托霉素非核糖体肽合成酶的完整CAT模块[30]。然而完整CAT(E)模块交换存在产量急剧下降的问题,且要求蛋白质序列具有高同源性,有一定的局限性。理解结构域间的连接区在非核糖体肽合成酶催化底物活化、加载、缩合过程中的作用,对于通过模块替换获取较好催化活性的杂合NRPS有重要作用。
Miller等[37]通过生物信息学分析了不同NRPS的A-T域间连接区后,在A-T域的连接区发现了一段保守的LPxP序列,该LPxP序列与A域C端的亚域相互作用以稳定A10基序中的保守赖氨酸;此外,该基序与A域C端的亚域相互作用可能会协调PCP域的运动与A域的构象变化。将LPxP序列中的Pro961突变后导致产物合成速率下降近一半[37]。同时有研究将发光杆菌(Photorhabdus luminescens)中单模块靛蓝合成酶IndC的T域用来自链霉菌的BpsA酶的T域替换后,破坏了靛蓝合成;令人惊奇的是,将BpsA酶的T域与A-T域间的连接区一起交换时恢复了靛蓝合成[38]。上述实验表明选择并保留合适的结构域间连接区对某些模块替换获得有活性的杂合NRPS至关重要。Calcott等[39]曾用CA域替换PvdD第二个模块(1.3),然而仅少数杂合NRPS具有较好催化活性,大多数杂合NRPS无功能[35]。随后,该团队以A-T间连接区为融合边界替换合成酶PvdD中T-C-AThr11催化单元(图3b)。虽然成功获得了两种Ser11和fhOrn11取代的pyoverdine衍生物,但是这两个衍生物的产量都较低。
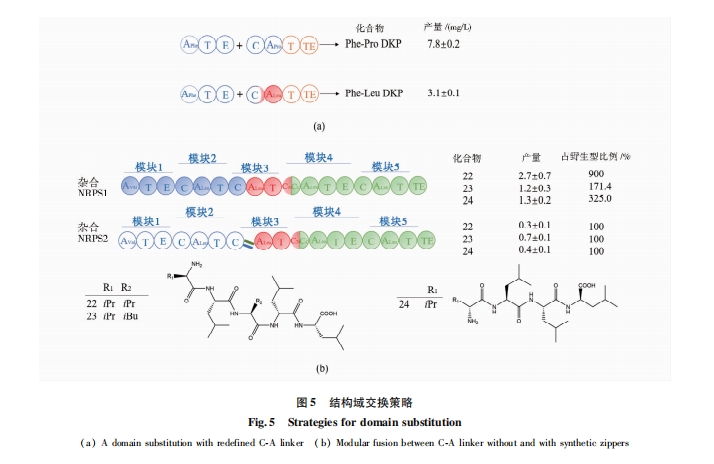
近年来德国法兰克福大学Bode团队发现CA结构域之间的连接区含一段保守序列LLLxxWNxT。利用此边界节点,在NRPS两个模块(CAT-CAT)之间选择AT-C区域为替换单元(exchange unit,XU)进行模块替换能获得活性较高的杂合NRPS蛋白,某些替换组合非核糖体肽的产量甚至比野生型提高了48%[40](图4b)。以A-T-C结构域作为交换单元进行模块替换和组合虽然取得了重大突破,而且可以进行多模块同时替换和组装,但这个方法局限性明显:首先,CA结构域之间的保守序列LLLxxWNxT在很多NRPS蛋白序列中并不存在。其次,现有理论显示C域对进入该结构域的氨酰-S-PCP受体具有很高的底物选择性,当杂合的A域识别的氨基酸与上游的C域不匹配时,肽链无法延伸导致无目标产物产生。因此,在对NRPS进行改造时,不仅需要考虑杂合NRPS的催化效率,还需要考虑C域对底物的选择性,避免杂合的A域识别的氨基酸与上游C域不匹配时肽链无法延伸导致无目标产物产生。
通过对C域的蛋白质结构分析,研究人员发现C域的N端是提供肽链的供体域(CDsub),C端是受体域(CAsub),它们分别接受肽基-S-PCP和氨酰-S-PCP。其中受体域(CAsub)对氨酰-S-PCP有特异识别作用[41]。例如,Kaniusaite等[42⇓-44]对糖肽类抗生素(glycopeptide antibiotics,GPAs)NRPS的改造实验也表明,C域对受体底物氨酰-S-PCP有强选择性。也有研究显示,C域不仅对受体底物氨酰-S-PCP有选择性,对供体底物肽基-S-PCP的大小和组成也有选择性[24,45⇓ -47]。对C域的结构解析也发现其具有立体和侧链选择性[48]。基于此理论Bozhüyük等[49]于2019年进一步开发了第二代的替换方案:用CAsub-A-T-CDsub作为基本的替换单元(exchange unit condensation domain,XUC)进行整体替换。该方案避免了杂合A域和C域之间氨基酸底物识别不匹配的问题,明显具有更广的适用范围,且该催化单元避免了破坏最主要的结构域-结构域相互作用[50],有的多肽产量比野生型提高了63.4%[49](图4c)。利用该方法可以构建多种随机组合的类似天然的非核糖体肽库。然而CAsub-A-T-CDsub作为交换单元的局限性在于:来源于同属的模块间易融合,而来源于不同属的模块间缺乏兼容性;TE结构域对氨基酸位置、肽链长度或环肽大小的特异性限制了全新的非天然、非核糖体肽以及环肽、缩肽形成[51]。
此方法避免了克隆和非核糖体肽合成酶大小的限制,可随机组合任意的NRPS模块,为快速实现新高通量生物组合方法、开发多肽类药物铺平了道路。
3 C域与A域的相互作用
3.1 C域改变A域的活性和选择性
从上述经典的NRPS生物合成理论可知,A域特异性识别氨基酸底物进行腺苷酰基化,C域在氨基酸缩合过程对受体氨酰-S-PCP的种类进一步校对验证(proofreading),A域和C域在底物选择过程中各自独立发挥作用,共同确保所合成非核糖体肽结构专一。但近年的研究报道显示C域对其相邻下游A域的底物选择性产生影响。Mayer等[57]将A域进行单独表达后,它可以腺苷酰基化多种氨基酸底物,但和C域联合表达后,A域只对精氨酸具有腺苷酰基化活性;单独表达A域时对天然底物酪氨酸和色氨酸均无活性,与C域联合表达后对这两种氨基酸具有腺苷酰基化活性。表明C域与A域的相互作用改变了A域的底物特异性,且某些A域只有在C域存在的条件下才具有活性。
此外,很多非脂肽类NRPS的起始模块并不含有C域,起始模块的A域腺苷酰基化氨基酸后通过T域直接转移到下一模块的C域进行氨基酸缩合。但是若采用NRPS延伸模块A域直接替代起始单元A域,目前尚未见肽链延伸成功的报道。近期Bozhüyük等[49]将C域(或C域C端的受体域CAsub)和延伸模块A域共表达时,成功地将延伸单元的A域转变为起始单元A域,产生了目标非核糖体肽化合物。
有研究在交换AT域时把C域C端作为杂合位点,杂合蛋白具有较高产量[58]。与最早的AT域替换通常导致产量下降[21,59 -60]相反,该实验中AT域的成功交换表明C-A间的相互作用界面对A域发挥活性功能很重要,当杂合的异源A域或AT域或AT-C域不包含此相互作用界面时,异源A域无法与上游C域正确互作,因此A域活性丧失,杂合NRPS无法发挥功能。上述实验表明在NRPS中每一组催化模块的C域和A域并非各自独立发挥作用完成一轮氨基酸延伸,C域与A域发生交互作用完善了A域腺苷酰基化的功能。
据此,结合生物信息学分析,研究者认为C结构域受体底物的特异性不是阻碍对NRPS工程化改造的因素。Calcott等[63]将PheATE- ProCAT模型中ProCAT模块A域以上述重组边界交换为L-Leu的A域后,成功合成了D-Phe- L-Leu,反驳了C域受体底物特异性这一假说,证明在交换NRPS催化模块时,通过选择有效的重组边界即可交换A域,实现对非核糖体肽生物合成途径改造,获取新的非核糖体肽。Calcott的实验对普遍公认的C域受体底物特异性这一理论提出了巨大挑战。然而其二肽合成中仅以识别L-Leu的A域交换ProCAT,因此存在偶然性,缺少对其他氨基酸特异的A域交换结果。
4 总结与展望
设计非核糖体肽的生物合成途径,以产生具有新结构或更好药理活性的新型化合物,一直是天然产物合成生物学的目标。基于非核糖体肽合成酶的线性催化机制,理论上定向重组催化模块可以获得任意氨基酸序列组合的多肽。然而杂合NRPS的催化效率限制了其可行性和实用性。随着对NRPS各功能域的结构研究日益深入,选择合适的催化单元和理想的重组边界使杂合NRPS可识别加载目的底物和提高其催化效率成为可能。因此,合理设计构建策略,允许催化单元任意重组,从而高效合成自然界尚未存在的化合物,对增加非核糖体肽家族化合物多样性、开发新药具有重大意义。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志