
摘要:穿膜肽是一类具有特殊穿膜功能的多肽分子 ,能携带其它分子甚至超分子颗粒穿膜进入细胞内部. 早期研究认为 ,其进胞是一种无需受体、也不存在饱和状态的非经典胞吞行为. 近年研究表明 ,其穿膜机制可能与其含有的氨基酸种类有很大关系. 现在 ,穿膜肽的穿膜过程称为巨型胞饮行为 ,它与传统的胞吞形式很相似. 当然 ,还可能存在着其它的进胞方式而没有被证明或发现. 关于穿膜肽的应用也是人们最感兴趣的 ,在很多领域的研究都在进行并不断取得进展. 不论是生物界还是医学界 ,穿膜肽都被认为将是一类非常有发展潜力的多肽分子。
Green等[3 ,4 ] 首先发现并证实人免疫缺陷病毒(HIV21) 的反式激活蛋白 TAT具有跨膜转移的功能.后经实验证明 ,真正起跨膜转运作用的其实是 TAT的一段被称为蛋白转导域 (PTD) 的特殊氨基酸序列(49~57 位氨基酸) . 在此之后 ,很多具跨膜功能的多肽分子陆续被发现. 现在 ,对穿膜肽的研究是生物科学和临床医药学等领域的热点 ,关于它们的结构、性质、穿膜机制及可能存在的细胞毒性等方面都展开了细致而深入的实验研究 ,从而使我们对其了解越来越全面.
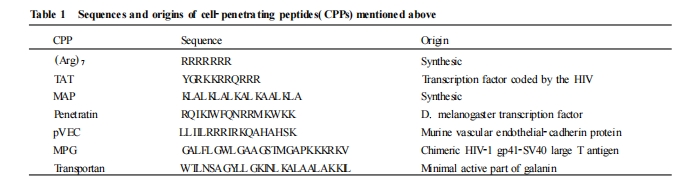
1 穿膜肽的特点及分类
2 穿膜肽的内化机制
碱性氨基酸的存在被认为是穿膜肽的一个标志. 通常大量电荷的存在排除了穿膜肽通过被动运输通过脂双层的可能. 当用其它的氨基酸残基代替精氨酸时对穿膜肽的能力影响较大. 如利用被丙氨酸取代的多肽 retro2pVEC ,D2pVEC 和 pVEC 进行比较研究时 ,发现 N 端第 5 位疏水性氨基酸被丙氨酸取代时其易位能力下降明显 ,当 Arg6 ,Arg8 或 Ser17被丙氨酸取代时 ,其被细胞摄入能力增强[7 ].
Geisler 等[8 ]比较了不同长度的具 Ⅱ型多聚脯氨酸螺旋骨架的两亲穿膜肽进胞能力 ,发现长序列的P14LRR比较短的 P11LRR 进入 MCF27 细胞的能力高 7~12 倍 ,比 TAT 高 35 倍. 利用荧光技术及 CD(circular dichroism) 光谱学技术 ,研究 2 种穿膜肽transportan 和 pAntp 及其突变体与不同电荷密度磷脂囊泡的相互作用实验表明 ,pAntp 及其突变体引起的膜混乱程度与他们的二级结构有关. 在螺旋状态 ,多肽对膜干扰很小. 当 pAntp 及其突变体变为β结构时 ,引起膜混乱. 定向 CD 表明 ,当 transportan 和pAntp 为螺旋状态时 , 只存在于囊泡膜表面 , 但pAntp 的两种突变体能进入膜内[9 ]. 通过研究 3 种主要的两亲性穿膜肽 Pβ,Pα和 Pep21 形成孔道的能力 ,也证明孔道的形成与多肽结构特征有很好的相关性 ,特别是它们的构象变化[10 ].
此外 ,负载物的大小和类型也会影响穿膜肽的穿膜能力. 一般情况下 ,小分子的负载物不影响内化(internalization) 的效率 ,但大分子负载物时 ,内化效率明显降低[6 ]. 对 Pep21 运输能力的研究发现 ,颗粒状负载物的颗粒大小和均匀性都直接依赖于 Pep21Π负载物组成比率 ,并与生物效率直接相关[11 ]. 因此 ,不同的穿膜肽在携带不同分子时采取的进胞方式可能有差异 ,同时其进胞时间也会不同.
早期观察发现 ,穿膜肽的内化过程可在 4 ℃的低温环境下发生 ,而且无饱和状态. 因此认为 ,该过程并非经典的胞吞作用 (endocytosis) ,也不需受体蛋白的介导[12~14 ]. 但是最近的研究结果表明 ,胞吞作用在内化过程中可能占有重要地位.
Nakase 等[15 ] 通过对 TAT 和其它富含精氨酸多肽的研究认为 ,早期使用细胞固定化技术、荧光显微镜技术及流式细胞计量技术等进行实验时 ,含有精氨酸多肽的内涵体膜经固定化过程会变得非常脆弱 ,极易破裂和泄露 ,从而使穿膜肽弥散分布于细胞质和细胞核处. 正是这些假象的出现使人们认为 ,穿膜肽穿膜不是经典的胞吞途径. 实际上 ,这些多肽带有大量阳离子并被膜强烈吸引 ,很难从高亲和力的细胞表面完全离开. 在低温下 ,用富含精氨酸多肽处理细胞时 ,并没有内吞作用出现 ,但由于固定操作而轻微紊乱的质膜会使细胞表面吸附的多肽逃脱进入胞质 ,从而出现了多肽内化进入胞质和核的假象. 利用完整的活细胞进行重新研究表明 ,在特定的情况下 ,内吞途径是这些多肽内化的主要途径. 定位于细胞膜的蛋白聚糖 ,包括硫酸乙酰肝素 ,被认为在内吞过程中起重要作用 ,这一特殊内吞过程被称为巨型胞饮(macropinocytosis) . 这个过程起始于细胞激活和质膜的边缘波动 ,从而吞噬大量的胞外液进入巨型胞饮泡. 在完整活细胞中 ,不进行固定化处理时 ,仍有少部分多肽进入胞质和核周围 ,说明可能还有一些其它的内化机制存在.
TAT和其它蛋白转导域以巨型胞饮途径实现转运的模型是一个多阶段过程 ,包括 TAT 与细胞表面结合、刺激巨型胞饮泡摄入 TAT 及其负载物、内涵体脱离进入细胞质中等一系列事件. 第一步中 TAT结合到细胞表面是通过细胞表面普遍存在的聚糖链完成的. TAT刺激巨型胞饮泡的出现其机制尚不知道 ,可能与细胞表面蛋白的结合有关 ,也可能通过蛋白聚糖或糖脂来实现. 通过巨型胞饮泡的摄入 ,所有的细胞都形成液态内吞形式 ,这对于 TAT 和多聚精氨酸的转导是必需的. 最后一步是从巨型胞饮泡逃脱进入细胞质 ,这个过程可能依赖内涵体中 pH 的下降 ,伴随其它因素使内涵体膜发生轻微紊乱 ,从而释放 TAT及其负载物[16 ].
热力学研究显示 ,非两亲的和中等两亲的穿膜肽与氨基葡聚糖( GAGs) 具高亲和力 ,但与真核细胞的亲和力很低. 因此 ,穿膜肽应该能与胞膜成分 ,如阴离子脂类和 GAGs 等通过静电结合 ,在低微摩尔浓度下以直接透膜的次要途径进胞. 这也支持了体内实验研究所揭示的穿膜肽低微摩尔浓度时胞吞作用是主要的摄取途径[17 ]. 当穿膜肽浓度达 100μmolL 以上的高浓度时 ,生物膜带有较多的阴离子成分,在低温时直接易位会比较明显.
穿膜肽的进胞途径可能有多种 ,至少包括直接易位和内吞作用. 至于哪种机制更有效 ,易位出现有多快依赖于实际情况 ,如穿膜肽类型、浓度、温度、细胞能量水平、负载的存在 ,胞膜中脂类组成等. 其中一个例子就是利用单层囊泡和钙黄绿素荧光基团研究穿膜肽 Tp10 及其突变体时发现 ,内化机制与是否有大的负载物有一定关系. 在缺乏大的亲水性负载物时 ,多肽诱导膜紊乱使肽直接易位进入胞内 ;当带有大的亲水性负载物时膜紊乱程度较低 ,内吞作用似乎是唯一的易位机制[12 ].
3 穿膜肽对细胞的影响
要将穿膜肽用于临床药物的运输工具 ,首先必须确认肽本身不会对正常细胞造成不利影响 ,在这方面已进行了一些研究 ,但大多是体外实验 ,体内研究较少. 通常研究主要集中在两部分 : ①对细胞膜和细胞器的毒性影响 ; ②穿膜肽与细胞成分相互作用而造成的毒性影响[6 ].
一些模式穿膜肽 ,如 MAP ,及人为设计的穿膜肽 ,如 transportan ,它们在结构上与抗菌肽类似 ,对细胞膜的稳定性有较大的影响. Saar 等[19 ] 研究了 5 种穿膜多肽 pAntp (43~58) 、pTAT(48~60) 、pVEC(615~632) 和 MAP、transportan10 等对 2 种人癌细胞株K562 和 MDA2MB2231 及永久主动脉内皮细胞的细胞膜毒性. 在所有细胞株中 ,pAntp (43~58) 、pTAT(48 ~ 60) 和 pVEC ( 615 ~ 632 ) 泄 露 ; 而 MAP 和transportan10 可引起明显的细胞泄露. 当 K562 和MDA2MB2231 胞处于 10μmolΠL MAP 和 transportan10中 10 min 时 ,即可使 40 %乳酸脱氢酶泄露. 有些研究表明 ,穿膜肽的毒性是与其种类、浓度和负载物密切相关的. 当 TAT(48~57) 浓度达 100μmolΠL 以上时仍基本上对所有细胞都无害 ,而 Antp (43~58) 却表现出明显的毒性. 在不考虑负载物序列时 ,与 TAT(48~57) 和 Antp (43~58) 结合多肽浓度大于 10μmolΠL 时触发明显的长度依赖毒性. 进一步数据还表明 ,毒性的发生与胞内两个应激信号通路的激活有关. 虽然包含蛋白转导域的 TAT 肽 (48~85) 在体外培养实验中未表现出神经毒性 ,但含α螺旋段(37~60) 的 TAT 肽对 HeLa 细胞的迁延照射会导致60 %细胞坏死. 而且 TAT 多肽 (43~60) 虽只表现10 %~15 %毒性 ,细胞短时间培养在 20~100μmolΠL的 PTD 浓度下也未表现任何不良作用 ,而 500μmolΠL PTD 在很短的时间内即可导致成纤维细胞功能改变. 提示 PTD 浓度超过 100μmolΠL 可能会导致毒性[21~24 ]. 由以上资料可以看出 ,要充分发挥穿膜肽独一无二的作用 ,对其毒性影响的进一步研究是非常必要的.
4 穿膜肽的应用前景
基于穿膜肽的特殊功能 ,关于它们应用方面的研究正在迅速展开. 穿膜肽可以携带的“货物”不只是小分子物质 ,还可以是多肽、蛋白质、核酸 ,甚至超分子颗粒.
Morishita 等[25 ]利用多聚精氨酸成功将胰岛素分子带入了细胞. 实验表明 ,单独胰岛素存在时观察不到肠吸收 ,但在同时给以 D2(Arg) 6 和 L2(Arg) 6 时呈现剂量依赖性明显的胰岛素肠吸收. D2(Arg) 6 比 L2(Arg) 6 对胰岛素吸收影响更大. 在多聚精氨酸中 D2(Arg) 8 对胰岛素肠吸收表现出最强的影响. 而且 ,此时并不需要将多聚精氨酸与胰岛素进行共价连接.可以想象如果这种方法成功 ,将为糖尿病患者的治疗带来多么深刻的影响. 其它多肽或蛋白 ,如神经元营养因子 ( GDNF)[26 ] 、β2半乳糖苷酶[27 ] 、强效胃酶抑素 A(PepA)[28 ] 等都被报道可通过与穿膜肽连接而有效进入细胞内部 ,GDNF 甚至可以通过血脑屏障.
RNA 干扰是研究基因功能、基因调控和基因治疗的有效方法. 双链 RNA 用以诱导序列特异性基因沉默. 为使特定基因沉默 ,合适的 siRNA 运输系统是必需的. 含 9 个精氨酸的穿膜肽能以非共价形式与EGFPsiRNA 形成复合物 ,并将其转运进入稳定表达绿色荧光蛋白的 GC2EGFP 细胞株中. 进入后 ,siRNA出现在细胞的核周区 ,并可最终实现其目标基因egfp 的沉默[29 ]. Unnamalai 等[30 ] 也用 CPP-siRNA 包装的运输方式成功介导 RNAi 进入烟草细胞. 利用设计合成的巨大分支的穿膜肽分子还能成功的将DNA 质粒分子转染进入多种哺乳动物细胞中 ,为DNA 分子的运输提供了新的选择 ,且效率比传统方法更高[31 ]
Sethuraman 等[32 ] 在极端 pH 敏感聚合物和穿膜TAT的基础上发展了一种新的针对酸性实体瘤的药物靶向运输系统. 运输系统包括 2 个组分 : ①含有疏水核心的由多聚 L2乳酸(PLLA) 构成的聚合胶团 ,其亲水外壳包含聚乙二醇 (PEG) 连接的 TAT 微团 ; ②极度 pH 敏感的由多聚异丁烯酰基磺胺地索辛(PST) 和 PEG(PSD2b2PEG) 构成的双重共聚体. 实验证明 ,TAT不仅易位进入细胞还可出现在核周围. 说明这样的运输系统可能携带任何疏水药物接近细胞核. 对此系统进一步的实验正在进行中 ,它为肿瘤靶向治疗带来了希望.
利用融合肽 diINF27 共包被形成免疫脂质体还能实现脂质体蛋白的胞质运输. 研究表明 ,尽管利用表面被穿膜肽 TAT 修饰的脂质体不能使脂质体颗粒直接易位穿过细胞膜 ,但细胞通过内吞作用对脂质体的摄入比未修饰的脂质体提高了[33 ].
5 结语
穿膜肽的研究是目前的一个重点和热点 ,我国也开展了一系列关于其结构特征、穿模机制与活性、潜在细胞毒性等的研究[34~37 ],并取得了一定的成果. 所有的研究都表明 ,穿膜肽可有效将多肽、蛋白质及 DNA 、RNA、超分子颗粒等 , 通过无受体介导、无耗能的方式 ,导入多种细胞中 , 且在一定浓度范围内不会造成细胞损伤. 虽然对于穿膜肽进入活细胞的具体机制尚无定论 ,但可以肯定其作为生物活性分子有效的细胞内转运工具 ,必将在细胞生物学、基因治疗、药物体内转运、临床药效评价以及细胞免疫学等多种研究领域发挥不可替代的作用. 伴随着研究的进行 ,尤其是对其穿膜机制研究的不断深入 ,我们还可能人工合成更多的、穿膜能力更强而毒性很小甚至无细胞毒性的穿膜肽 , 以用于疾病治疗等其它方面.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志