
摘 要 目的:制备T7肽修饰的硫酸长春新碱(VCR)-脱铁铁蛋白(APO)纳米粒,并研究其对胶质瘤细胞的体外靶向性。方法:采用解离-重组法制备VCR-APO纳米粒,以靶头(T7肽)修饰后制成T7-VCR-APO纳米粒。采用质谱分析和紫外-可见分光光度法评价靶头连接效率,并对所制纳米粒进行形态、粒径、Zeta 电位、包封率等进行表征。以胶质瘤 C6 细胞为模型,考察T7-VCR-APO纳米粒对C6细胞及肿瘤球的靶向作用,并以低温条件和4种细胞内吞抑制剂考察C6细胞对T7-VCR-APO纳米粒的摄取机制。结果:经质谱检测证明T7肽已连接在纳米粒上,连接率为68.39%;所制得的T7-VCR-APO纳米粒形态圆整、均一,粒径为(31.14±1.26)nm,Zeta电位为(-23.30±0.42)mV,包封率为(39.49±2.84)%。体外靶向性研究显示,T7-VCR-APO纳米粒可有效地被C6细胞及肿瘤球摄取,并可到达肿瘤球核心位置;C6细胞对纳米粒的摄取是多通路共同作用的结果,主要是通过小窝蛋白介导的内吞并伴随巨胞饮途径。结论:本研究成功制得T7-VCR-APO纳米粒,其能够对胶质瘤C6细胞实现体外靶向递送药物,入胞效率大大提高。
脑胶质瘤是最富于血管的人体肿瘤之一,其具有恶性化程度高、生长速度快、患者生存期短等特点[1]。脑胶质瘤极易侵入周围正常组织间隙从而与正常脑组织分界不清,导致手术几乎不可能完全切除,如果采用单纯的手术切除反而会刺激肿瘤,加快其增殖速度、加重其恶变程度[2-3]。因此,在脑胶质瘤切除术后常常需要辅以放疗、化疗,以延缓肿瘤复发、延长患者生存期[4]。然而由于脑胶质瘤增长迅速,肿瘤部位因缺氧而对放疗不敏感,而化疗药物又大多具有严重的副作用或难以透过血脑屏障(BBB),给术后治疗带来了许多困难。基于此,探寻新的、安全有效的治疗方法是目前脑胶质瘤治疗领域的研究重点,其中药物治疗在脑胶质瘤综合治疗策略中具有重要地位。
硫酸长春新碱(VCR)为临床常用的一线抗癌药物,但其对BBB的透过率不高、生物利用率较低,长期使用极易引起肿瘤细胞对药物的耐受[5]。为了解决以上问题,本课题组选用 VCR 为模型药物,以脱铁铁蛋白(Apoferritin,APO)纳米粒为载体包载 VCR,并以 T7 肽对纳米粒进行修饰,制备T7-VCR-APO纳米粒。其中,APO源于人体天然蛋白,相对于其他人工合成的材料具有生物相容性良好、毒性低、半衰期较长等优点,是优良的纳米级药物载体[6];T7 肽作为小分子多肽,具有可化学合成、稳定性好、靶头基团空间位阻小等优点,与在BBB和胶质瘤细胞的表面均高表达的转铁蛋白(Tf)受体亲和性强,能够协助载药纳米递释系统透过BBB并向胶质瘤细胞浓集,直接作用于病灶部位,从而提高药物的生物利用度和治疗效果[7]。同时,本课题组还考察了T7-VCR-APO纳米粒对胶质瘤细胞的体外靶向性,以期为开发一种能有效治疗脑胶质瘤的新型药物递释系统提供参考。
1 材料
BT25S 型电子分析天平、PB-10 型 pH 计[赛多利斯科学仪器(北京)有限公司];DF-101S型磁力搅拌器(巩义市科华仪器设备有限公司);Heal Force型CO2培养箱(美国Thermo公司);3K-15型台式高速冷冻离心机(美国 Sigma-Aldrich 公司);UV-1800型紫外-可见分光光度计(上海菁华科技仪器有限责任公司);JEM1230型透射电镜(日本电子株式会社);Nano-ZS90型马尔文激光粒度仪(英国Malvern公司);1200型高效液相色谱仪(美国Agilent Technologies公司);TCS SP2型激光共聚焦显微镜(德国Leica公司)。
VCR(海南长春花药业有限公司,批号:20150902,纯度:≥98%);APO纳米粒胶体溶液(北京成志科为生物科技有限公司,批号:A36101);琥珀酰亚胺酯-聚乙二醇3500-马来酰亚胺(SCM-PEG3500-MAL,上海甄准生物科技有限公司,批号:22268p082);T7肽;5(6)-羟基二乙酸荧光素(CFDA,批号:21877-1G-F)、N,N′-二环己基碳二亚胺(DCC,批号:D80002-25G)、N- 羟 基 琥 珀 酰 亚 胺 酯(NHS,批 号 :130672-5G)均购自美国 Sigma-Aldrich 公司;荧光染料Cyanine 5.5 NHS ester(cy5.5,广州市锐博生物科技有限公司);DMEM高糖培养基(赛默飞世尔仪器有限公司,批号:8117149);胎牛血清(浙江天杭生物科技股份有限公司,批号:11011-8611);胰蛋白酶(美国 Amresco 公司);磷酸盐缓冲液(PBS,pH 7.4)为本课题组自配,其余试剂均为分析纯,水为双蒸水。
鼠源神经胶质瘤细胞(C6细胞)、鼠源脑微血管内皮细胞(bEnd.3细胞)均来源于北京协和细胞资源中心。
2 方法
本 课 题 组 先 以 APO 包 载 模 型 药 物 VCR(即 得VCR-APO纳米粒),再采用双功能基团SCM-PEG3500-MAL为连接桥梁,以—MAL基团与T7肽中的巯基反应生 成 稳 定 的 硫 醚 键(即 得 功 能 性 化 合 物 SCMPEG3500-T7),然后以—SCM 基团与 APO 中的伯胺反应形成稳定的酰胺键,从而使T7肽与VCR-APO相连接,即制得 T7-PEG3500-VCR-APO 纳米粒(简称“T7-VCRAPO纳米粒”)。
2.1.1 VCR-APO 纳米粒的制备 采用解离-重组法。首先取适量APO纳米粒胶体溶液于小烧杯中,于磁力搅拌器上搅拌(350 r/min,下同);滴加 0.1 mol/L HCl 溶液调节 pH 至 2.0,搅拌 10 min;然后滴加 1 mg/mL VCR 水溶液0.2 mL,搅拌1 h;再滴加0.1 mol/L NaOH溶液调节pH至4.5左右,搅拌20 min;继续滴加0.1 mol/L NaOH溶液调节 pH 至 7.4,搅拌 10 min。采用透析袋(截留分子量:300 kDa)透析24 h除去游离的VCR,即得包载VCR的APO纳米粒胶体溶液(简称VCR-APO纳米粒)。
2.1.2 功能性化合物的制备 称取 SCM-PEG3500-MAL适量,以PBS制成溶液;加入T7肽适量,室温下于磁力搅拌器上搅拌反应24 h。透析(截留分子量:3 500Da)24 h除去游离的T7肽,即得SCM-PEG3500-T7。
2.1.3 T7-VCR-APO 纳米粒的制备 取“2.1.1”“2.1.2”项下制备的 VCR-APO纳米粒与功能性化合物各适量,避光室温孵育24 h,透析(截留分子量:300 kDa)24 h除去游离的SCM-PEG3500-T7,即得T7-VCR-APO纳米粒。
靶向制剂的靶头连接率的大小很大程度上决定着制剂透过细胞膜的效率,因此需考察功能性化合物SCM-PEG3500-T7中的靶头(即T7肽)的连接效率。本课题组采用基质辅助激光解吸电离飞行时间(MALDI-TOF)质谱分析表征靶头连接情况;同时,考虑到T7肽与APO载体分子量差异较大,故采用超滤离心法和紫外-分光光度法测定靶头连接率。
2.2.1 靶头荧光标记 精密称取荧光探针 CFDA 适量溶解于二甲基亚砜(DMSO)中,依次加入适量的 DCC、NHS,室温避光搅拌24 h,4 000 r/min离心15 min。取上清液,加入适量的SCM-PEG3500-T7和三乙胺,室温避光反 应 24 h 后 透 析(截 留 分 子 量 :3 500 Da),即 得SCM-PEG3500-T7-CFDA(即荧光探针标记的功能性化合物)。
2.2.2 靶头连接情况表征 采用MALDI-TOF质谱分析进行靶头连接情况表征。将“2.2.1”项下制得的 SCMPEG3500-T7-CFDA送军事医学科学院仪器分析中心进行质谱分析,以判断CFDA标记的T7肽靶头是否与纳米粒成功连接。
2.2.3 靶头连接率测定 (1)建立 CFDA 标准曲线方程。取CFDA适量,以PBS制成系列质量浓度(1.5、2.0、2.5、3.0、3.5 μg/mL)的溶液,采用用紫外-可见分光光度计于493 nm波长处测定吸光度(A);以A对质量浓度(c,μg/mL)进行线性回归,得回归方程 A=0.195 0c+0.007 1(R2=0.999 3)。(2)测定荧光探针标记的功能性化合物中CFDA 的含量,以间接反映所连接的 T7 肽含量。取“2.2.1”项下制备的SCM-PEG3500-T7-CFDA 适量[需适当稀释一定倍数(D),以使吸光度符合仪器测定要求],按“2.2.3(1)”项下方法测得A,代入回归方程计算,即得T7肽的总含量C 总(以CFDA含量测定结果作为T7肽的含量);再采用超滤离心管对样品溶液进行10 000 r/min离心(截留分子量:30 kDa)15 min,收集下层液体,同法测定计算,即得游离T7肽的含量C 游离。(3)按公式计算靶头连接率[连接率(%)=(C 总×D 总-C 游离×D 游离)/(C 总×D 总)×100%]。
2.3 T7-VCR-APO纳米粒的表征
2.3.1 形态 取T7-VCR-APO纳米粒适量,以水适当稀释后滴加在铜网上,稍等片刻再滴加磷钨酸染色,于透射电镜下观察T7-VCR-APO纳米粒的形态。
2.3.2 粒径分布 取T7-VCR-APO纳米粒适量,滴入已加水的比色皿中,采用马尔文激光粒度仪测定其粒径分布。
2.3.3 Zeta电位 取T7-VCR-APO纳米粒适量,以水适当稀释后加入样品池中,采用马尔文激光粒度仪测定其Zeta电位。
2.3.4 包封率 由于本研究是在载体APO包载VCR完成后再连接的T7肽,因此不考虑T7肽对药物包载的影响,采用超滤
离心法测定VCR-APO纳米粒包封率。取“2.1.1”项下制备的 VCR-APO 纳米粒 1 mL,加入 0.1mol/L HCl 调节pH至2.0,加水定容至2 mL,采用高效液相色谱法检测[色谱柱:ZORBAX SB-C8(250 mm×4.6mm,5 µm),流动相:甲醇-1.5%二乙胺水溶液(70 ∶ 30,V/V),柱温:30 ℃,流速:1 mL/min,检测波长:297 nm,进样量:20 µL],测得 W 总(即 VCR 加入总量);另取VCR-APO 纳米粒 1 mL,10 000 r/min离心10 min,取下层液体,同法测得W 游离(即游离的VCR量);计算VCR的包封率[包封率(%)=(W 总-W 游离)/W 总×100%]。
2.4 T7-VCR-APO 纳米粒对肿瘤细胞的体外靶向性研究
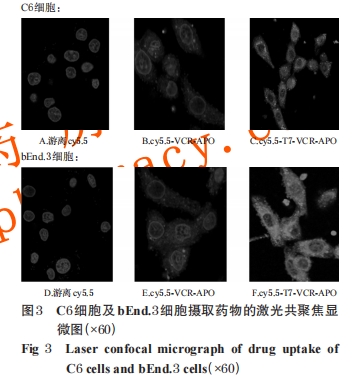
2.4.1 单层 C6 细胞及 bEnd.3 细胞摄取实验 由于bEnd.3细胞是BBB的主要组成部分,而纳米粒到达脑部病灶的关键是要先透过bEnd.3细胞从而进入BBB,然后才能到达脑内肿瘤细胞,因此考察了两种细胞的摄取行为。(1)C6、bEnd.3 细胞培养。于 37 ℃、5%CO2培养箱中,以含10%胎牛血清的 DMEM 高糖培养基(简称“培养液”)培养 C6、bEnd.3 细胞,每 2 天换 1 次培养液。(2)cy5.5-VCR-APO、cy5.5-T7-VCR-APO 溶液的制备。取“2.1”项 下 制 备 的 VCR-APO、T7-VCR-APO 溶 液 各 2mL,分别加入 2.5 mg/mL 荧光染料 cy5.5 溶液 0.08 mL(以 DMSO 为溶剂),在磁力搅拌器上避光搅拌反应 24h,避光透析(截留分子量:300 kDa)24 h,所得透析液即为荧光标记的 cy5.5-VCR-APO、cy5.5-T7-VCR-APO 溶液。(3)C6、bEnd.3细胞对不同药物的摄取行为考察。①将C6、bEnd.3细胞以1×105个/孔分别接种于激光共聚焦培养小皿中,每皿 2 mL,平行接种 3 个小皿,于 37 ℃、5%CO2条件下培养 24 h,使细胞贴壁。②待细胞贴壁后,用PBS漂洗2次,每皿加入培养液1.8 mL,在两种细胞的各3个小皿中分别加入游离cy5.5、cy5.5-VCR-APO、cy5.5-T7-VCR-APO 溶液各 0.2 mL,于 37 ℃、5%CO2条件下培养4 h。③培养完毕后吸弃培养液,用4 ℃预冷的PBS 漂洗 2 次,加入 4%多聚甲醛固定、二苯甲亚胺(Hoechst 33258)染料进行细胞核染色,以 50%甘油封片,4 ℃避光预冷。④在激光共聚焦显微镜下观察游离cy5.5、cy5.5-VCR- APO、cy5.5-T7-VCR-APO溶液的细胞摄取情况。
2.4.2 肿瘤球摄取实验 细胞肿瘤球模型与单层细胞模型相比,能更好地模拟体内实体肿瘤生理环境,因此本课题组采用C6细胞构建肿瘤球模型,以此考察实体肿瘤对T7-VCR-APO纳米粒的摄取能力。
将 C6 细胞以 1×107个/mL 接种于 6 孔板中,置于37 ℃、5%CO2条件下培养,待细胞完全连成片后吸弃培养液,加入少量胰蛋白酶消化细胞。待细胞完全脱落后终止消化,小心将细胞转移到已铺满琼脂的6孔板上,培养3~4 d即成肿瘤球。吸取肿瘤球细胞团转移到已铺满琼脂的24孔板上,待肿瘤球沉降后,吸弃上层培养液,使每孔剩余培养液约50 µL,并保证每孔均有大量肿瘤球。每孔加入适量的 cy5.5-T7-VCR-APO 溶液和培养液,在37 ℃、5%CO2条件下培养4 h,再按照“2.4.1”项下方法将肿瘤球固定、染核、封片,4 ℃避光预冷后在激光共聚焦显微镜下进行自上而下的层切拍照。
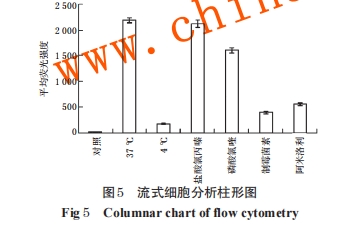
2.4.3 细胞摄取机制考察 考虑到肿瘤细胞对纳米粒的摄取可能是通过细胞内吞作用实现的,而细胞内吞具有能量依赖性特点,在较低的温度条件下会受到抑制[8],因此本课题组分别考察了在低温条件和内吞抑制剂作用下肿瘤细胞对纳米粒的摄取效果,以期阐明纳米粒对肿瘤细胞的体外靶向机制。(1)将C6细胞以1×105个/孔接种于激光共聚焦培养小皿中,在37 ℃、5%CO2条件下培养 24 h,使细胞贴壁,分为两组。(2)一组培养小皿用不含胎牛血清的DMEM高糖培养基(简称“无血清培养液”)换液培养,于 4 ℃、5%CO2条件下培养 30 min;加4 ℃预冷的 PBS漂洗2次,再加入 4 ℃预冷的以无血清培养液稀释的cy5.5-T7-VCR-APO溶液 2 mL,继续培养4 h,以此考察低温对细胞摄取纳米粒效果的影响。(3)另一组培养小皿用PBS漂洗2次,分别加入含有4种内吞抑制剂的无血清培养液(20 µmol/L 盐酸氯丙嗪、100µmol/L 磷酸氯喹、25 µmol/L 制霉菌素、50 µmol/L 阿米洛利)适量,在 37 ℃、5%CO2条件下培养 30 min;加入cy5.5-T7-VCR-APO 溶液 200 µL,继续培养 4 h,以此考察内吞抑制剂对细胞摄取纳米粒效果的影响。(4)培养结束后,吸弃小皿培养液,用PBS漂洗2次,加入0.25%胰蛋白酶(含1 mmol/L乙二胺四乙酸)消化并吹打成单细胞悬液,1 000 r/min离心5 min,用4 ℃预冷的PBS漂洗3次并重悬细胞;细胞悬液过300目细胞筛,采用流式细胞仪进行检测。
3 结果
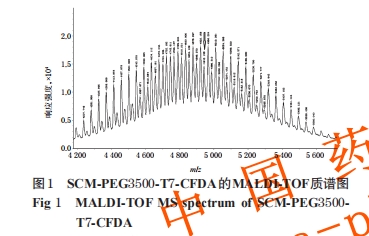
3.1.2 靶头连接率测定结果 由紫外-可见分光光度法测得A 总、A 游离分别为0.797、0.632,代入回归方程计算得C 总、C 游离分别为4.05、3.20 μg/mL。由于测定C 总、C 游离时分别将样品稀释了10、4倍,因此按公式计算得靶头连接率为68.39%。

3.2.2 粒径 经检测,T7-VCR-APO 纳米粒的粒径为(31.14±1.26)nm。
3.2.3 Zeta 电位 经检测,T7-VCR-APO 纳米粒的 Zeta电位为(-23.30±0.42)mV。所测得电位的绝对值越大则体系越稳定,纳米粒子电位绝对值大于15 mV即可达到稳定性要求[9]。以上结果表明所制得的纳米粒体系较稳定。
3.2.4 包封率 经检测,VCR-APO 纳米粒的包封率为(39.49±2.84)%。
3.3 T7-VCR-APO 纳米粒对 C6 细胞及 bEnd.3 细胞的体外靶向性研究结果

4 讨论
APO具有独特的空腔结构和解离重组性质,它作为一个生物尺寸可控的生物载体已被广泛地应用于纳米载体新剂型的开发领域[11]。而将药物包裹在纳米笼中也有两种方法:一种是解离-重组法,其原理是APO在不同pH条件下发生解离-重组时,能将药物包裹在其中;另一种是扩散法,其原理是利用APO的通道性[12]。本课题组采用解离-重组法制备VCR-APO纳米粒。
BBB 和胶质瘤细胞的表面均高表达 Tf 受体,以往研究常采用Tf对纳米载药系统进行修饰,但机体内源性的 Tf 浓度高,会竞争性抑制 Tf 修饰的载药系统的靶向转运[6]。T7 肽对 Tf 受体的亲和性与 Tf 相当,能实现对BBB 与脑胶质瘤细胞的双级靶向传递作用,但其在 Tf受体上的结合位点与 Tf 不同,因此不会受到内源性 Tf的竞争性抑制,相反内源性 Tf 与 Tf 受体的结合还会提高T7肽的入胞效率[10]。为提高纳米粒对肿瘤的靶向性,本课题组将T7肽修饰在了APO纳米粒载体表面。经制剂相关表征显示,所得纳米粒各项指标均符合设计要求,且制备方法方便易行;靶头连接效率评价结果显示,T7肽成功连接到载体表面,连接率达到68.39%,能满足靶向制剂的要求。
对纳米载体给药系统进行细胞穿透性能评价最有效的方法是体外细胞吞噬实验[7]。本课题组采用在胶质瘤研究领域应用最广泛的C6细胞为模型,进行单层肿瘤细胞和肿瘤球的摄取行为考察,结果显示经靶头修饰制得的T7-VCR-APO纳米粒较之于未经修饰的纳米粒,能更有效地穿透C6细胞及肿瘤球,并且可以到达肿瘤球的核心处,入胞效率大大提高。同时,本课题组采用低温条件和盐酸氯丙嗪、磷酸氯喹、制霉菌素、阿米洛利等4种细胞内吞抑制剂(分别对网格蛋白介导的内吞、内涵体酸化、小窝蛋白介导的内吞和巨胞饮途径起作用[10])考察纳米粒穿透 C6 细胞的机制。结果证明,T7-VCR-APO纳米粒对C6细胞的穿透作用是通过细胞的内吞作用实现的,而且是多个通路共同作用的结果,主要是通过小窝蛋白介导的内吞并伴随巨胞饮途径。
综上所述,纳米粒连接 T7 肽后其穿透胶质瘤细胞的靶向效果明显增强,因此T7肽修饰的APO纳米粒靶向给药系统是一个很有潜力的抗肿瘤药物载体,其能通过与在 BBB 和胶质瘤细胞表面均高表达的 Tf 受体结合,实现药物在体内的脑肿瘤靶向作用。本研究证实了T7肽作为靶向配体用于抗脑胶质瘤治疗药物研发的意义,并为今后相关新型制剂的研发提供了理论依据,期望能为脑胶质瘤的临床药物治疗提供新的选择。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志