
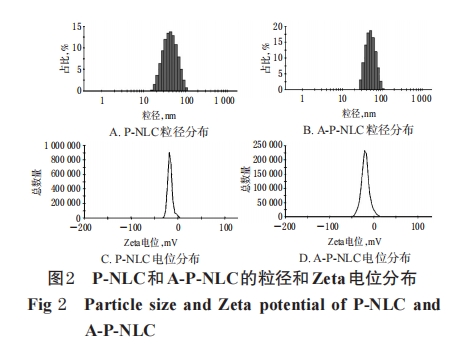
摘 要 目的:制备序列为丙氨酸-谷氨酸-酪氨酸-亮氨酸-精氨酸(简称为“AEYLR”)的小肽修饰的紫杉醇(PTX)纳米结构脂质载体(A-P-NLC),并对其体内外抗肿瘤效果进行评价。方法:采用熔融乳化-低温固化法制备纳米结构脂质载体(NLC)、PTX纳米结构脂质载体(P-NLC)和A-P-NLC,表征其外观形态、粒径、多分散指数(PDI)、Zeta电位,并检测其包封率、载药量及体外释放度;以NCI-H1299细胞和S180细胞为对象,采用CCK-8法对游离PTX、P-NLC、A-P-NLC(0.44~44.00 μg/mL,以PTX计)的细胞抑制作用进行考察,并计算其半数抑制浓度(IC50);以S180荷瘤小鼠为模型动物,对游离PTX、P-NLC、A-P-NLC(5 mg/kg,以PTX计)的抑瘤效果进行评价。结果:P-NLC和A-P-NLC外观均呈类圆形、分布均匀;A-P-NLC的粒径、PDI、Zeta电位分别为(43.92±0.76)nm、0.203±0.034、(-19.77±1.16)mV,较P-NLC有所增加;A-P-NLC的包封率、载药量分别为(95.71±0.68)%、(1.97±0.25)%,较P-NLC有所降低;A-P-NLC在48 h内累积释放百分率达(35.17±2.08)%,较游离PTX表现出明显的缓释作用,且比P-NLC的释放更缓慢。与游离PTX和P-NLC比较,相同质量浓度的A-P-NLC对NCI-H1299细胞和S180细胞的抑制率大部分均显著升高,IC5值均显著降低;A-P-NLC给药处理的S180荷瘤小鼠无死亡现象,一般状态良好,且瘤体积显著缩小、瘤质量显著降低、瘤质量抑制率显著升高(P<0.05或P<0.01)。结论:A-P-NLC具有明显的缓释作用,其对NCI-H1299细胞和S180细胞的体外抑制作用以及对小鼠S180实体瘤的抑制作用均优于游离PTX和P-NLC,且毒性有所降低。
紫杉醇(Paclitaxel,PTX)是从红豆杉中提取的一种四环二萜类化合物,在临床上主要用于乳腺癌、卵巢癌、非小细胞肺癌等的一线/二线治疗;其常规剂型为溶液型注射剂,但该类剂型含有的增溶剂聚氧乙烯蓖麻油会引起过敏反应,故将其制备成各种纳米制剂以降低其毒性已成为研究热点[1-4]。纳米结构脂质载体(Nanostructrued lipid carriers,NLC)是采用单甘油酯、双甘油酯、其他类甘油酯、磷脂、鞘脂类等脂质为载体,并添加一定比例的液态油,将药物吸附或包裹于脂质核中而形成的脂质纳米给药系统[5-6]。NLC具有良好的生物相容性,适于静脉注射、口服等多种途径给药[7-8],具有极大的潜在应用价值。序列为丙氨酸-谷氨酸-酪氨酸-亮氨酸-精氨酸(Ala-Glu-Tyr-Leu-Arg,简称为“AEYLR”)的小肽来自于表皮生长因子受体(EGFR)自磷酸化位点 Y1173,前期研究已证明其对 EGFR 高表达的肿瘤具有良好的体内外靶向性[9-10]。为降低抗肿瘤药物的毒性并提高其靶向性,本课题组将 PTX 制成 AEYLR 小肽修饰的 NLC(简称为“A-P-NLC”),对其进行表征,并对其体内外抗肿瘤效果进行评价,为 PTX 抗肿瘤制剂的进一步开发提供实验基础。
1材料
AL204型电子天平[梅特勒-托利多仪器(上海)有限公司];DF-101S型集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);HT7700 型透射电子显微镜(日本Hitachi公司);Zetasizer Nano-ZS90型纳米粒径电位分析仪(英国Malvern公司);ZHWY-200D型恒温培养振荡器(上海智城分析仪器有限公司);2695型高效液相色谱仪(美国Waters公司);5804R型台式高速大容量离心机(德国 Eppendorf 公司);3111 型细胞培养箱(美国Thermo Fisher Scientific 公司);Tecan Safire 2型酶标仪(瑞士Tecan公司);ARZ型电子数显游标卡尺(宁波市鲁匠工具有限公司);MD44MM透析袋(美国Viskase公司,截留分子量:8 000~14 000 Da)。
PTX对照品(,批号:17022701,纯度:≥98%);二硬脂酰基磷脂酰乙醇胺-聚乙二醇 2000-AEYLR(DSPE-PEG2000-AEYLR,广州特立生物科技有限公司,批号:GT60304-0324-A,纯度:≥90%);CCK-8试剂盒(碧云天生物技术有限公司,批号:20332);山嵛酸甘油酯(ATO,法国Gattefossé公司);单硬脂酸甘油酯(GMS,马来西亚KLK公司);中链三酰甘油(MCT,北京凤礼精求商贸有限公司);聚氧乙烯35蓖麻油(ELP)、聚乙二醇-15-羟基硬脂酸酯(HS15)(德国BASF 公司);RPMI 1640培养基、胎牛血清(美国Gibco公司);聚山梨酯80(美国Sigma公司);pH 7.4磷酸盐缓冲液(PBS,由北京酷来博科技有限公司的固体粉末产品用超纯水配制);乙腈为色谱纯,其余试剂均为分析纯或实验室常用规格,水为纯化水或超纯水。
人非小细胞肺癌细胞NCI-H1299、小鼠腹水瘤细胞S180均购自中国科学院典型培养物保藏委员会细胞库。
SPF级昆明小鼠50只(雌性30只、雄性20只),体质量 18~22 g,购于哈尔滨医科大学实验动物学部,生产许可证号:SCXK(黑)2013-001。所有动物均饲养于SPF级实验室,环境温度为 18~22 ℃、湿度为 50%~60%,饲喂清洁级真空包装小鼠饲料。
2 方法与结果
采用熔融乳化-低温固化法进行制备。称取 ATO40 mg、GMS 13 mg、MCT 27 mg、ELP 54 mg 作为油相,另称取/量取 HS15 54 mg、水 4 mL 作为水相,将油相和水相分别置于 80 ℃水浴中熔融或溶解;在恒温磁力搅拌下,将油相缓慢滴入水相,待滴加完成,继续乳化 10min;随后将油水混合物迅速置于冰水浴中固化15 min,再分别经0.45 μm、0.22 μm微孔滤膜滤过后,即得NLC溶液。另外,先单独将 5 mg/mL 的 PTX 无水乙醇溶液200 μL(挥干乙醇)或与DSPE-PEG2000-AEYLR 8 mg同时加入上述油相中,再按同样的操作方法分别制得PTX纳米结构脂质载体(P-NLC)溶液和修饰有AEYLR小肽的 PTX 纳米结构脂质载体(A-P-NLC)溶液。3 种 NLC样品溶液均显蓝色乳光。

采用高效液相色谱(HPLC)法测定PTX含量。色谱条件:色谱柱为Diamonsil C18(250 mm×4.6 mm,5 μm);流动相为乙腈-水(55 ∶ 45,V/V);流速为 1 mL/min;柱温为 25 ℃;检测波长为 227 nm;进样量为 20 μL[11]。精密称取 PTX 对照品适量,以流动相制成质量浓度分别为5.0、10.0、25.0、50.0、100.0 μg/mL的系列标准溶液,按上述色谱条件测定;以 PTX 的峰面积(A)对质量浓度(c,μg/mL)进行线性回归,得标准曲线方程为A=0.558 5c+0.910 7(r=0.999 8)。结果表明,PTX 的质量浓度在5.0~100.0 μg/mL范围内线性关系良好。
采用超滤离心法[12]测定样品的载药量和包封率。取“2.1”项下制备的 P-NLC 样品溶液适量,置于超滤离心管(截留分子量:10 kDa,下同)中,10 000 r/min 离心40 min,收集下清液,经甲醇适当稀释后,按上述色谱件进样测定,得游离药物含量(W 游离);另取P-NLC样品溶液适量,置于离心管中,经乙腈破乳后,3 000 r/min 离心20 min,取上清液,按上述HPLC色谱条件进样测定,得总药物含量(W 总)。按照公式计算 P-NLC 的载药量(DL)和包封率(EE):DL(%)=(W 总 -W 游 离)/W 脂 质 ×100%,EE(%)=(W 总-W 游离)/W 总×100%;式中,W 脂质为处方中液态脂质和固态脂质的总量[13]。另取“2.1”项下制备的A-P-NLC样品溶液适量,同法测定。试验均重复3 次 。结 果 ,P-NLC 和 A-P-NLC 的 载 药 量 分 别 为(99.13 ± 0.86)% 、(95.71 ± 0.68)% ,包 封 率 分 别 为(2.33±0.15)%、(1.97±0.25)%,A-P-NLC 的载药量和包封率较P-NLC均有所降低。
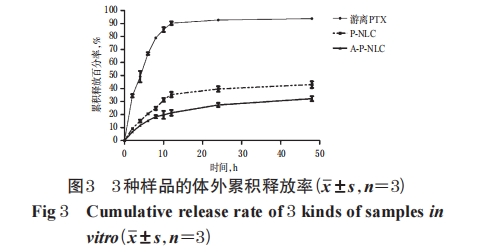
取游离PTX和“2.1”项下制备的P-NLC和A-P-NLC样品溶液适量,采用透析法[13]模拟药物释放过程,设置截留分子量为10 kDa、释放介质为含0.2%聚山梨酯80的PBS,于0、2、4、6、8、10、12、24、48 h时取样,按“2.3”项下 HPLC 法测定 PTX 质量浓度,考察其体外释放度,并按公式计算累积释放百分率:累积释放百分率(%)=[V0×Ct+V(C1+C2+C3+……+Ct-1)]/m×100%,其中,m是加入制剂含药总量,V是每次取样体积,V0是释放介质的总体积,C1、C2、C3……Ct分别是第1、2、3……t取样时间点的浓度。试验均重复3次。结果显示,游离PTX在12 h时的累积释放率已达到(90.00±2.33)%,而 P-NLC、A-P-NLC 在 48 h 时的累积释放百分率分别为(43.053.74)%、(35.17±2.08)%;与游离 PTX 比较,P-NLC 和A-P-NLC 均表现出明显的缓释作用,且 A-P-NLC 较P-NLC的释放更缓慢,详见图3。
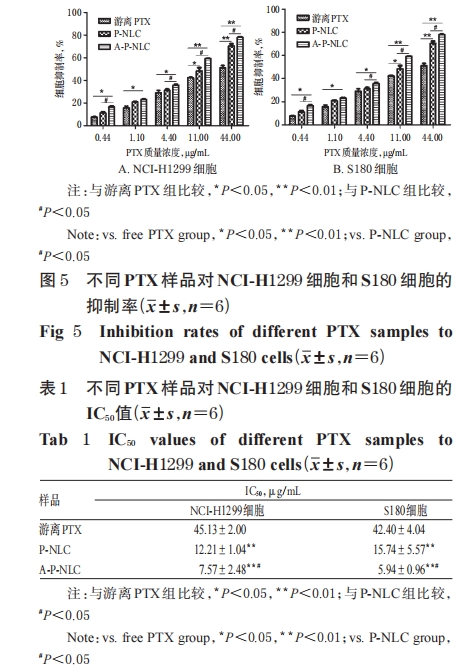
2.5.2 不同PTX样品的细胞抑制作用 按“2.5.1”项下方法取细胞接种并培养,分为对照组(细胞+培养基)和各药物组(细胞+游离PTX或P-NLC或A-P-NLC的含药培养基,所含 PTX 的终质量浓度均分别为 0.44、1.10、4.40、11.00、44.00 μg/mL);另设不含细胞的空白组(培养基),每组设置6个孔。剂量均根据预试验结果设置。按照“2.5.1”项下方法培养并测定各孔OD值,并按公式计算细胞抑制率:细胞抑制率(%)=(OD 药 物 组 -OD 空 白 组)/(OD 对照组-OD 空白组)×100%。采用SPSS 17.0软件进行统计分析,数据以x±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验(P<0.05为差异有统计学意义);同时,计算药物的半数抑制浓度(IC50)。
2.6.1 S180荷瘤小鼠模型建立 取对数生长期的S180细胞,以4 ℃生理盐水漂洗并调节细胞浓度至1×107个/mL,按200 μL/只接种于小鼠(雌性10只)的腹腔[14]。4~5 d后可见小鼠腹部凸起、明显增大,此时取其S180腹水瘤细胞用于传代[13]。传至第3代后,抽取腹水瘤模型小鼠的腹水,以 4 ℃生理盐水漂洗并调节细胞浓度至 1×108个/mL,另取小鼠(雌雄各20只),按200 μL/只注射至其腋窝皮下,并观察其腋窝处实体瘤形成情况。当小鼠腋窝处出现小的突起且触摸有硬结感时,即为荷瘤造模成功。
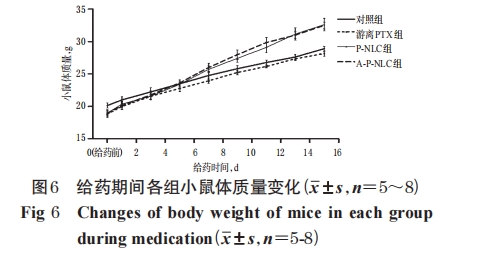
2.6.2 A-P-NLC 的体内抗肿瘤作用考察 取“2.6.1”项下造模成功的荷瘤小鼠 32 只,随机分为对照组、游离PTX组、P-NLC组、A-P-NLC组,每组8只。各组小鼠均尾静脉给药100 μL/次,隔天1次,连续8次。除对照组给予生理盐水外,各给药组的给药剂量均以5 mg/kg PTX计算,剂量根据预试验结果设置。每天观察小鼠一般状态,并测量其体质量;以游标卡尺测量肿瘤垂直方向上的长径(a)和短径(b),计算肿瘤体积(V=ab2/2)[15];末次给药24 h后处死小鼠,剖取肿瘤,称定瘤质量,并按公式计算瘤质量抑制率:瘤质量抑制率(%)=(1-给药组瘤质 量/对 照 组 瘤 质 量)× 100% [16]。统计学方法同“2.5.2”项。
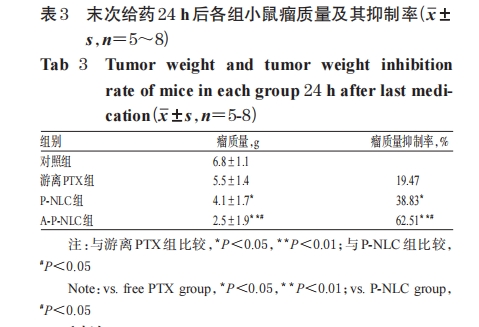
各组小鼠瘤体积均随时间延长而呈增加趋势;与对照组比较,各给药组小鼠自给药3 d时起瘤体积均显著缩小,P-NLC组和A-P-NLC组小鼠在末次给药后24 h时瘤质量均显著降低;与游离 PTX 组比较,P-NLC 组和A-P-NLC 组小鼠分别自给药 7、5 d 时起瘤体积显著缩小,在末次给药后24 h时瘤质量显著降低、瘤质量抑制率显著升高;与P-NLC组比较,A-P-NLC组小鼠自给药7 d时起瘤体积显著缩小,在末次给药后24 h时瘤质量显著降低、瘤质量抑制率显著升高。以上差异均有统计学意义(P<0.05或P<0.01),详见表2、表3。

3 讨论
经 PEG 修饰的 NLC 可通过“高渗透、长滞留”效应被动靶向进入肿瘤组织,即通过肿瘤微血管的空隙渗漏进入肿瘤组织,但进入肿瘤组织的NLC因其表面修饰有PEG 故亲水性增强,会使其跨膜进入细胞受到影响;AEYLR 小肽对 EGFR 具有特异的靶向性,可使连接有AEYLR的NLC对EGFR高表达的细胞及肿瘤组织具有主动靶向作用,同时还可通过EGFR受体介导肿瘤细胞对NLC的内吞,提高NLC的入胞量[9-10]。
DSPE-PEG2000-AEYLR 是 AEYLR 通过 PEG 末端活化技术连接在 DSPE-PEG2000 末端的产物。本研究采用熔融乳化-低温固化法制备 A-P-NLC,在乳化过程中DSPE-PEG2000-AEYLR结构中的亲水部分PEG2000-AEYLR存在于乳滴表面,而在低温固化后AEYLR部分即被修饰到了P-NLC的表面。与P-NLC比较,A-P-NLC在制备过程中加入了 DSPE-PEG2000-AEYLR,增加了NLC表面PEG的量,导致粒径、粒度分布及Zeta电位绝对值均有所增长,同时空间位阻的增加使其包封率和载药量略有降低;二者的体外释放行为相似,均有缓释效果,但 A-P-NLC 的缓释效果更为明显,可能是由于DSPE-PEG2000-AEYLR的加入使P-NLC的结构变得更加稳定,从而使药物释放更缓慢。
本研究选择 EGFR 高表达的人非小细胞肺癌细胞系NCI-H1299和鼠源S180细胞系[17-18]作为模型细胞,主要考察了 A-P-NLC 对两种肿瘤细胞的体外抑制效果。结果显示,与游离PTX和P-NLC比较,加入了具有主动靶向作用的AEYLR后,A-P-NLC显示出更强的体外肿瘤细胞抑制效果。而进一步采用S180细胞建立小鼠荷瘤模型并进行体内抑瘤作用考察的结果显示,与游离PTX组和P-NLC组比较,A-P-NLC组小鼠的瘤体积、瘤质量均显著缩小或降低,瘤质量抑制率均显著升高;另外,游离 PTX 组有 3 只小鼠由于 PTX 的长期毒性而死亡,而P-NLC组与A-P-NLC组小鼠死亡情况减少,且体质量较游离PTX组显著增长,提示PTX制成NLC后可减小药物的毒副作用,提高用药安全性。
综上,A-P-NLC 具有明显的缓释作用,其对 NCIH1299 细胞和 S180 细胞的体外抑制作用以及对小鼠S180 实体瘤的抑制作用均优于游离 PTX 和 P-NLC,且毒性有所降低。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志