
摘要: 疟疾依然是全球重要的公共卫生问题之一,全球仍有近一半人口面临感染风险。目前,耐药性虫株的不断出现和扩散使得传统抗疟药逐渐失效。因此,研发新的抗疟药物迫在眉睫。抗菌肽是机体天然免疫防御系统的重要组成部分,为抵御致病性入侵提供了第一道防线,其优先攻击细胞膜的作用机制使其不易产生耐药性,因此被认为是新型抗疟药物的优质候选资源之一。本文对具有抗疟活性的抗菌肽——抗疟多肽研究进展进行综述,并对其作为新型抗疟药物的研究前景进行展望。
疟疾是一种由疟原虫感染引起、通过按蚊传播的感染性疾病,与艾滋病、结核病一起被列为全球三大传染病[1]。据WHO报道,2021 年全球仍有 2.47 亿例疟疾病例,61.9万例疟疾患者死亡[2]。恶性疟原虫是危害人体最为严重的疟原虫,绝大部分与疟疾有关的死亡病例都是由恶性疟原虫感染引起,其中90%发生在撒哈拉以南非洲地区,多数为5岁以下儿童。该地区孕妇及其胎儿极易感染疟疾,是造成新生儿体质量过轻、贫血和死亡的主要原因[3]。目前,疟疾疫苗效果有限,主要依靠抗疟药物进行化学治疗,但近几十年来抗疟药的不合理使用导致了疟原虫药物抗性产生和迅速扩散,使得包括氯喹、甲氟喹、磺胺多辛、乙胺嘧啶、哌喹等经典抗疟药物逐渐失效[4]。2001年,WHO正式推荐以青蒿素为基础的联合用药作为治疗恶性疟的一线用药[5],然而在大湄公河次区域出现了疟原虫对青蒿素敏感性下降的现象[6],甚至在南美洲和东南亚普遍出现了多重抗性株。截至2015年2月,该抗性区域已扩大到整个大湄公河流域,最近一些非洲国家也有恶性疟原虫对青蒿素产生耐药性的相关报道[7⁃8]。因此,寻找新的替代药物迫在眉睫。
抗菌肽是生物体内产生的一种小分子活性肽,是机体天然免疫防御系统的重要组成部分,不仅有免疫调节活性,而且具有抗细菌作用,对一些真菌、原虫亦具有活性,为抵御致病性入侵提供了第一道防线[9⁃11]。这些天然和合成的多肽在大小、电荷、氨基酸组成、疏水性和二级结构上都不同,其中一些对感染疟原虫的红细胞和胞内寄生虫细胞膜具有选择性作用[12]。抗菌肽优先攻击细胞膜的作用机制使其不易产生耐药性,因此,抗菌肽成为对抗耐药性疟原虫的候选资源。迄今报道的抗菌肽序列超过3 000个[13],根据其二级结构的不同,通常将抗菌肽分为α⁃螺旋型抗菌肽、β⁃折叠型抗菌肽、具有环状结构的抗菌肽和片层结构抗菌肽。近年来,研究者们分离和合成了多种具有抗疟活性的抗菌肽——抗疟多肽,本文从抗疟多肽的分类和作用机制对其研究现状进行阐述,并探讨其作为新型抗疟药物面临的挑战和应用前景。
1 抗疟多肽分类
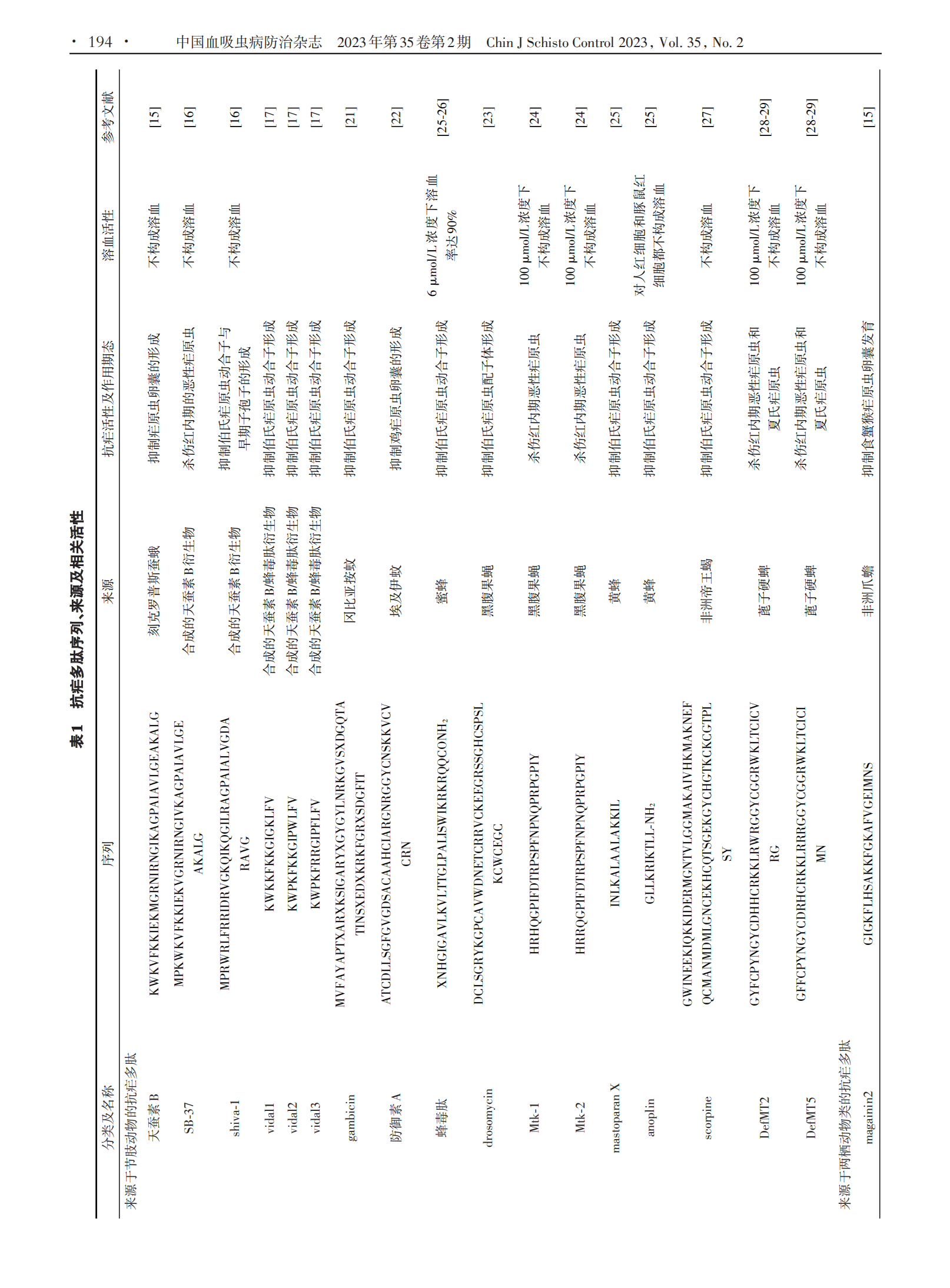
1.1 来源于节肢动物的抗疟多肽 昆虫纲是地球上最大的动物类,是抗菌肽的广泛来源[14]。迄今为止,抗菌肽数据库中列出的3 087个抗菌肽中有305个来源于昆虫[13]。其中,来自天蚕蛾的天蚕素B是第一个被发现具有抗疟活性的抗菌肽,可干扰卵囊发育为孢子,其半数致死剂量(LD50)为0.5 ~ 1.0 μg/μL[15]。随后研究者人工合成了天蚕素B的衍生物Shiva⁃1和SB⁃37,前者与天蚕素B具有40%同源性,但活性是天蚕素B的2倍;后者与天蚕素B高度同源,活性相当[16]。Vida1 ~ Vida3 是一类合成的天蚕素 B/蜂毒肽衍生物,100 µmol/L Vida3二聚体对伯氏疟原虫动合子抑制率达100%,同等浓度的Vida1 ~ Vida3单体对伯氏疟原虫动合子抑制率也可达到70%左右[17]。
有些昆虫本身就是一些寄生虫病的传病媒介,如按蚊是疟疾的传播媒介,这些传播媒介在进化过程中形成了强大的防御系统来抵御携带寄生虫所致的危害,如上调一氧化氮合酶表达、在对疟原虫具有耐受性的蚊子中抑制寄生虫发育的黑化包囊作用[18⁃19],以及可能在这种耐受性中起重要作用的抗菌肽产生等。在撒哈拉以南非洲地区的恶性疟原虫主要媒介中发现了防御素、天蚕素和冈比亚霉素等多种抗菌肽[20⁃21]。冈比亚按蚊抗菌肽主要在中肠血细胞样细胞中表达,在感染疟原虫 2 h 内其水平显著升高。gambicin 是来源于冈比亚按蚊的一种经免疫诱导的抗菌肽,主要表达于按蚊前胃室、胸腔和腹部,10 µmol/L gambicin与伯氏疟原虫体外作用24 h,即可使其动合子形成数降低 54.6%[21]。埃及伊蚊等其他蚊媒亦可产生具有抗疟活性的抗菌肽,其可产生3种40个氨基酸长度的防御素(DefA⁃C)和天蚕素A以应对细菌感染。在过表达天蚕素A和防御素A的转基因埃及伊蚊中,鸡疟原虫卵囊增殖受到显著抑制[22]。
一些来源于其他寄生虫病昆虫媒介的抗菌肽亦具有抗疟活性,从黑腹果蝇中分离的drosomycin就是其中之一。对 drosomycin 及其衍生肽进行的抗伯氏疟原虫ANKA虫株配子体发育试验结果显示,其衍生肽drosomycins⁃2在20 µmol/L剂量下显示出30%的抑制作用,而原型肽 drosomycin 在相同浓度下显示出70%以上的抑制作用[23]。Mtk⁃1和Mtk⁃2是来源于黑腹果蝇的抗菌肽,在结构上属于富含特定氨基酸的片层结构。这两种抗菌肽在体外对恶性疟原虫3D7虫株表现出较高抗疟活性,在50 µmol/L药物浓度下达到75% ~ 80%抑制率,且两者在体外对大鼠和猪红细胞均无溶血活性[24]。anoplin是一种从黄蜂毒液中分离纯化出来的抗菌肽,仅由10个氨基酸组成,与mas⁃toparan⁃X 具有高度同源性,预测其同为两亲性 α⁃螺旋结构,是迄今为止在自然界中发现的最小线性α⁃螺旋抗菌肽。Carter 等[25]发现 anoplin 可以显著抑制伯氏疟原虫动合子形成。蜂毒肽是一种来源于蜜蜂的抗菌肽,与anoplin相同,蜂毒肽亦具有抑制伯氏疟原虫动合子形成的作用,在 50 µmol/L 浓度下作用 30min即可达到100%抑制率[25⁃26]。scorpine是一种来源于非洲帝王蝎的离子通道阻滞剂,对伯氏疟原虫配子和动合子均有显著抑制作用,其半数有效剂量(ED50)分别为10 µmol/L和0.7 µmol/L[27]。
来源于其他节肢动物的抗菌肽亦具有抗疟活性。一些来源于蓖子硬蜱的防御素在体外具有抗疟活性,这些防御素在结构上属于半胱氨酸稳定的α⁃螺旋和β⁃折叠抗菌肽家族,在体外可显著抑制恶性疟原虫生长,这种抑制作用呈剂量依赖性,其中DefMT2和 De⁃fMT5 在体外 50 µmol/L 药物浓度下对恶性疟原虫的抑制率可达到65%和85%[28]。鼠疟模型实验结果表明,它们在体内同样具有抗疟活性,小鼠感染夏氏疟原虫24 h后经眼眶后单剂量(6 mg/kg)注射给药后12 h,与对照组相比,多肽处理组小鼠体内原虫密度显著降低,在体外对恶性疟原虫无抗疟活性的DefMT6在体内亦显示出了一定的抗疟活性[29]。
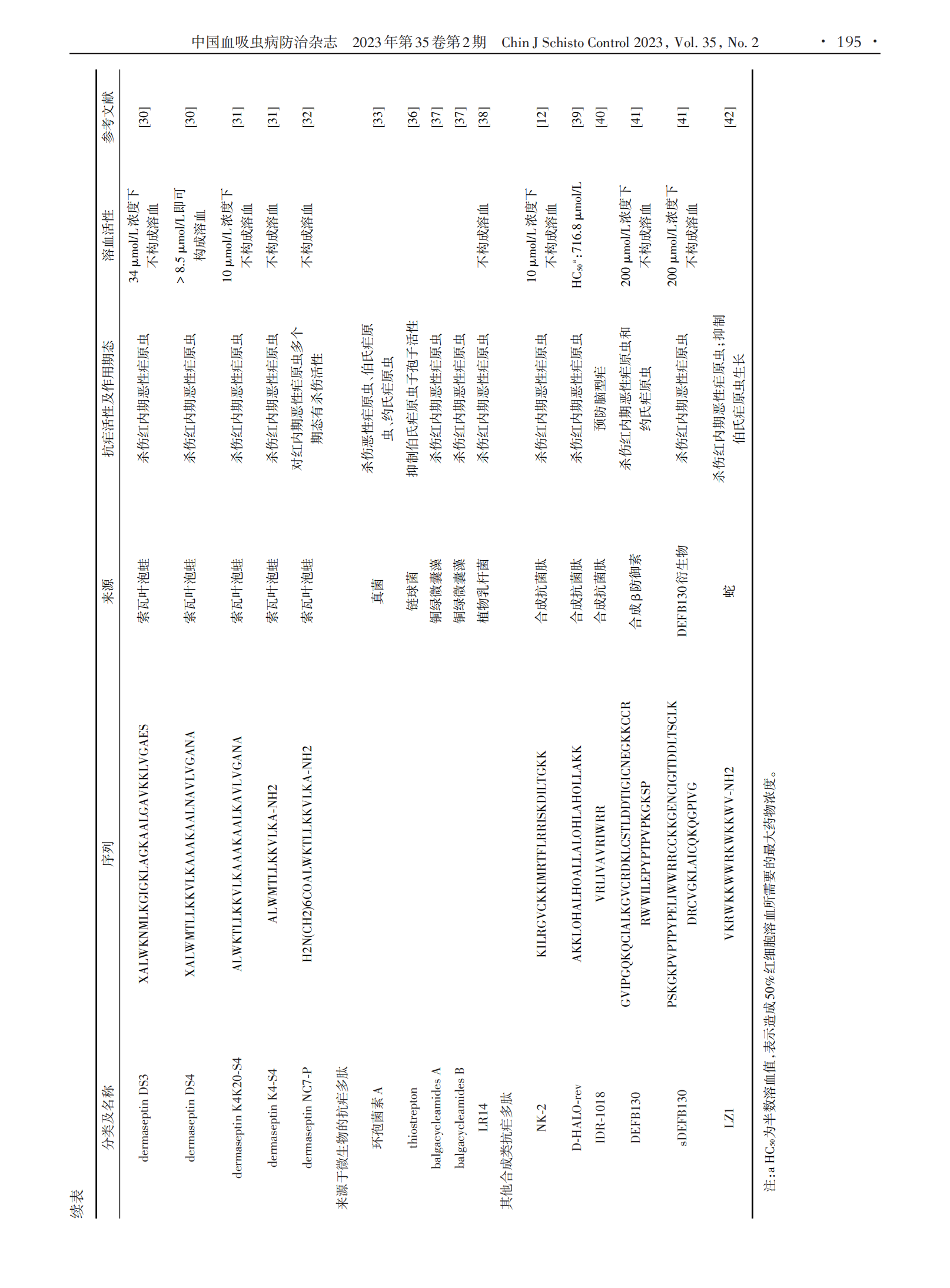
1.2 来源于两栖动物类的抗疟多肽 一些来源于两栖动物皮肤的抗菌肽对不同恶性疟原虫虫株红内期具有抗疟活性。dermaseptins是从索瓦叶泡蛙皮肤中分离出来的一类在结构和功能上相关的抗菌肽家族,它是一种线状阳离子多肽,由28 ~ 34个氨基酸残基组成,在极性溶剂中以两亲α⁃螺旋形式存在,主要通过介导两亲α⁃螺旋与质膜磷脂相互作用来发挥其抗疟活性,对恶性疟原虫红内期多个期态起作用[30]。其中 dermaseptin S3(DS3)和 dermaseptin S4(DS4)在体外对氯喹敏感虫株HB3具有抗疟活性,其半数抑制浓度(IC50)分别为8.8 µmol/L和2.2 µmol/L。此外,DS3和DS4同样对氯喹抗性虫株 Ibrahim 表现出一定程度 的 抗 疟 活 性 ,IC50 值 分 别 为 1.5 µmol/ L 和 2.5µmol/L;但DS4在体外具有溶血活性,在浓度高于8.5µmol/L时可造成红细胞溶血[30]。为降低DS4溶血活性,研究人员筛选出 dermaseptin K4K20⁃S4、derma⁃septin K4⁃S4(1⁃13)a 和 dermaseptin NC7⁃P 等一系列DS4衍生物,相关研究表明这些衍生物抗疟活性与其自身性质有关,疏水性更强的衍生物具有更高抗疟活性,其中一些衍生物在抗疟活性与溶血活性之间表现出显著选择性[31⁃32]。magainin2是一种从非洲爪蟾中分离出来的由23个氨基酸组成的抗菌肽,经magain⁃in2治疗的感染食蟹猴疟原虫的按蚊肠卵囊形成数量显著减少[15]。
1.3 来源于微生物的抗疟多肽 一些来源于微生物的抗菌肽也具有抗疟活性。其中,从丝状真菌培养液中分离出来的环孢菌素A是第一个被发现具有抗疟活性的环状抗菌肽,其不仅在体外对恶性疟原虫具有抗疟活性,在体内对伯氏疟原虫和约氏疟原虫也同样具有抗疟活性[33]。thiostrepton 是一种来源于链球菌的环状抗菌肽,可通过调节蛋白酶活性和疟原虫顶端复合体蛋白翻译来抑制子孢子活性[34⁃35],其IC50值为1.8 ~ 17 µmol/L[36]。balgacycleamides A ~ C是从铜绿微囊藻 EAWAG 251 中分离出的 3 种新大杂环抗菌肽,其中 balgacycleamides A 和 balgacycleamides B 对恶性疟原虫氯喹抗性菌株K1具有抗疟活性,其IC50值分别为 9.0 µmol/L 和 8.2 µmol/L,并且这些环状抗菌肽在150 µmol/L浓度下对大鼠成肌细胞系L6细胞无细胞毒性[37]。此外,从植物乳杆菌培养液中分离纯化的由 4 种肽组成的抗菌肽 LR14 也具有抗疟活性,当体外药物浓度达到 42 μg/mL 时,其对恶性疟原虫敏感虫株3D7的抑制率可达到99%;同时,其对氯喹抗性株 RKL19 亦具有抗疟活性,且这种抗菌肽在体外不会造成红细胞溶血[38]。
1.4 其他合成的抗疟多肽 NK⁃2是首类具有抗寄生虫活性的合成抗菌肽之一,由39 ~ 65个氨基酸残基组成。荧光标记观察发现,NK⁃2可与疟原虫及其感染的红细胞结合,但不与健康红细胞结合,进一步证明了 NK⁃2 具有选择性裂解活性[12]。D⁃HALO⁃rev 也是一种合成的抗菌肽,由26个氨基酸组成,在体外对恶性疟原虫有抗疟活性,能够在较低浓度下穿透感染红细胞并杀死红细胞内寄生虫,其 IC50 值约为 0.1μmol/L[39]。IDR⁃1018是一种合成的天然防御调节肽类似物,由12个氨基酸残基组成,具有免疫调节作用及抗菌活性。这种合成多肽还有预防脑型疟作用,预防性静脉注射后,56%的疟原虫感染小鼠可免受脑型疟影响[40]。最近,一种合成的β防御素DEFB130被发现在体内外都具有抗疟活性,这种防御素在结构上属于 α⁃螺旋和 β⁃折叠的抗菌肽家族,在体外对恶性疟原虫的IC50值为43 ~ 49 µmol/L;其衍生肽sDEFB130在体外对恶性疟原虫亦具有一定抗疟活性,但较原多肽活性较低,IC50值为90 ~ 93 µmol/L,并且这两种抗菌肽在200 µmol/L浓度下都不会造成红细胞溶血[41]。国内有研究团队合成了一种来源于蛇组织蛋白酶的抗菌肽LZ1,其对红内期恶性疟原虫表现出了较强抑制作用,IC50值为 3.045 µmol/L;LZ1 对伯氏疟原虫亦产生了显著的体内抗疟活性,且呈时间和剂量依赖性,同时还显示出抗炎作用,可以减轻肝功能损害[42]。其他合成的具有抗疟活性的抗菌肽还有 pohlianin C及其3个衍生肽。pohlianin C是一种富含甘氨酸的环状抗菌肽,在体外显示出中等抗疟原虫活性,其类似物结构更加简单,但其抗疟活性并未受到影响,甚至得到了增强[43]。
2 抗疟多肽作用机制
目前抗疟多肽的作用机制尚未完全阐明,结合抗菌肽作用机制和已有抗疟多肽研究,其抗疟机制主要包括膜破坏机制和非膜破坏机制。
2.1 膜破坏机制 抗疟多肽通常是两亲性阳离子多肽,可以与带负电的寄生虫膜相结合,通过破坏寄生虫膜完整性,造成细胞内容物泄漏,导致疟原虫死亡[44]。除了直接作用于疟原虫膜,抗疟多肽还可以通过作用于感染疟原虫的红细胞膜来发挥其抗疟作用。红细胞被疟原虫感染后,其细胞膜发生显著变化,膜上磷脂酰乙醇胺增多,而溶卵磷脂和鞘磷脂含量减少[45],前者通过磷脂酰丝氨酸脱羧合成,是抗疟多肽的最终靶标。有研究揭示了抗菌肽NK⁃2具有磷脂酰丝氨酸依赖性裂解作用,这表明小阳离子抗疟多肽可能对感染疟原虫的红细胞具有选择性[12]。
2.2 非膜破坏机制 除了膜破坏机制,抗疟多肽还可以通过影响胞内细胞器、核酸及抗菌物质的合成等方式来杀伤疟原虫[45]。如thiostrepton 可通过调节蛋白酶活性和疟原虫顶端复合体蛋白翻译来达到杀伤疟原虫的效果[35]。除了直接杀死疟原虫外,抗疟多肽还发挥免疫调节功能,它们由包括中性粒细胞和巨噬细胞在内的免疫细胞分泌,并参与感染的缓解过程。如一些抗疟多肽通过减少促炎细胞因子分泌来避免细胞因子风暴和组织损伤、免疫细胞募集和激活、促进血管生成以及抑制过量活性氧释放等来改变宿主免疫反应,从而调节严重受损器官损伤[40, 46]。LZ1可以改善疟原虫感染小鼠肝脏损伤[42],IDR⁃1018可以减少疟原虫感染引起的神经炎症[40, 47]。
3 抗疟多肽的应用前景及其面临的挑战
3.1 抗疟多肽的应用前景 传统的抗疟药大多是小分子化合物,有特定的靶标分子,长期使用可能使其靶标分子突变从而产生抗性。为延缓药物抗性蔓延,复方抗疟药不断推出,但绝大多数复方组分均为已知抗疟药,如复方蒿甲醚的主要组分是青蒿素衍生物、科泰复的有效成分是双氢青蒿素和磷酸哌喹[48]。疟原虫对这些配伍用药已产生或多或少抗性,因此该策略并不能从根本上解决在全球快速蔓延的抗疟药抗性问题。此外,也有一些作用机制不同、结构新颖的新一代抗疟药物不断涌现,比如能够抑制疟原虫二氢乳清酸脱氢酶(PfDHODH)的DSM265[49],以及抑制P型阳离子转运体 ATP 酶 4(PfATP4)的 KAE609[50],还有其他一些作用机制不明确的化合物。但这些化合物类药物的共性都是针对某个特定靶标,无法避免抗性出现。因此,寻找新型抗疟药物是临床疟疾治疗和防止疟疾传播的迫切需求,具有重要的科学研究意义。
近年来,多肽作为治疗药物已越来越受到关注。随着生物技术与多肽合成技术的日臻成熟,越来越多的多肽药物被开发并应用于临床。多肽药物目前已广泛应用于肿瘤、糖尿病、艾滋病等疾病预防和治疗,具有广阔的开发前景[51]。而抗菌肽作为免疫系统的第一道防线,可以有效识别入侵的外源病原体,包括寄生虫。此外,生物体会进化出一系列抗菌肽对抗病原微生物感染[9],因此,天然抗菌肽是很好的抗疟多肽资源。多肽药物的质量控制水平接近于小分子化合物、活性接近于蛋白质类药物,而其作用机制不同于小分子化合物,不容易产生抗性。此外,在临床应用和生产制备上具有高活性、低剂量、低毒性等优点。
3.2 抗疟多肽研发面临的挑战 虽然目前已经发现了大量具有抗疟活性的多肽,但这些多肽的抗疟活性研究尚存在局限性和片面性。如 gambicin 在按蚊体内表现出抗疟活性,但蚊体内一些天然肽本身就会影响寄生虫的生存状态,因而很难确定此类多肽实际的抗疟活性[21]。对于作用于体外培养的红内期疟原虫多肽,多数缺乏体内有效性验证。这类多肽的抗疟活性需要更系统的研究,以确定最有效和最具选择性的多肽结构,并且需要在鼠疟模型中进行验证。此外,作用机制的揭示将有助于指导多肽设计和药物研发,而多数抗疟多肽的作用机制尚不明确。
虽然多肽在抗药性方面具有优势,但目前极少有涉及寄生虫对多肽抗性的研究。尚不确定多肽在疟原虫中是否更“抗药”,这取决于多肽抗疟原虫的作用机制。尚不明确它们是对疟原虫(或受感染的红细胞)的细胞膜发挥相对非特异性作用,还是具有其他特异性靶标。产生抗药性疟原虫的倾向必须通过长期实验来确定。从体外短时间培养或啮齿动物中很难分离和鉴定抗药疟原虫突变体,以及临床数据的缺乏,都是抗疟多肽耐药性研究中面临的困难。
抗疟多肽的研发除了遇到以上瓶颈外,多肽类药物还有生产成本高、给药不便、稳定性不高的缺点。但随着未来技术的发展与给药途径的丰富,人们将会克服这些缺点,并且将新兴肽类技术应用到制药中,包括多功能肽、细胞穿透肽和多肽偶联药物,将大大拓展治疗性多肽药物的应用范围。
4 结语
虽然多肽的临床应用到目前为止一直受到限制,但一段时间以来,多肽一直是抗菌和其他抗菌化合物的来源。其中一些药物与其他抗菌药物相比具有潜在优势,包括作用范围广、杀灭活性快,以及存在合成和生物方法来生成种类繁多的类似物。也许最吸引人的特点是,对多肽的抗药性出现得很慢,而多肽药物未来的发展将继续建立在天然肽的优势上,并用现代技术进行改良,改善其化学和物理性能弱点。因此,抗疟肽作为新型抗疟药物,可望为抗药性疟原虫治疗带来新的希望。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志