
摘要: 血管紧张素转换酶( angiotensin converting enzyme,ACE) 通过作用于维持血压正常的肾素-血管紧张系统 ( rennin-angiotensin system,RAS) 和激肽释放酶-激肽系统 ( kallikrein-kinin system,KKS) ,使其失衡导致血压升高. 而 ACE 活性抑制肽可以竞争性地与 ACE 的活性中心结合,从而抑制 ACE 的活性,使血压降低. 天然来源的 ACE 抑制肽与传统的降压药物相比效果较好,无毒副作用,对正常血压没有影响,对于高血压的治疗和人类健康具有重要意义. 本文以酪蛋白中提取的ACE 活性抑制肽KVLPVP为先导肽,根据ACE抑制肽的结构特点,设计合成一系列的类ACE肽( similar ACE-like peptides) . 利用反相高效液相色谱法( RP-HPLC) 直接测定其体外 ACE 抑制活性. 结果表明,当芳香性的氨基酸残基 Phe、Tyr、His 和疏水性 Val 残基位于 C-端时会提高多肽的ACE 抑制活性,尤其是 His 位于 C-端时,ACE 抑制活性更强. 通过对比先导肽与所合成的类 ACE肽的 ACE 活性抑制率,可以发现,类 ACE 肽的 ACE 活性抑制率均高于先导肽. 基于不同氨基酸残基位于C-端时对多肽的 ACE 抑制活性的研究,可以为降血压药物分子设计和筛选提供基础.
高血压是最常见的慢性病,也是心脑血管病最主要的影响因素,它能引起脑卒中、心肌梗塞、心力衰竭以及慢性肾脏病等并发症,潜 在 的 危 害 性大[1,2]. 近年来,随着人们生活水平的提高,高血压的发病率也呈上升趋势,严重威胁着人类健康[3-7].血管紧张素转化酶( angiotensin converting enzyme ,ACE) 是一种广泛存在于哺乳动物体内的含 Zn2 + 外肽酶,它不仅可以将没有催化活性的血管紧张素 I转化为对血管收缩具有促进作用的血管紧张素 II;而且也可以使舒缓肌肽失活[8,9],对人体血压的调节起到重要作用[10]. 目前,人们多使用合成的 ACE抑制剂如卡托普利等药物来治疗高血压,但这些药物存在一定的副作用和不良反应,天然来源的 ACE抑制肽可最大程度地减少传统降压药物产生的一些不良反应,在控制和治疗高血压方面有着很大潜力,因此成为人们研究的焦点[9,11].
1970 年,Ferreira等[12] 在蛇毒液中提取出ACE 抑制肽( ACE inhibitory peptides) ,目 前 已 有很多 ACE 抑制肽的研究报道. 其中 发 现 从 酪 蛋白源中提取分离出来 的KVLVPQ、MAIPKK,服 用很少剂量就能起到很显著的降压作用[13-15]. 但是,天然来源的 ACE 抑制肽结构单一,较多的研究集中在其活性,而很少研究其构效关系. 本文以天然提取的 ACE 活性抑制肽 KVLPVP( 酪蛋白源) 为先 导 肽,根 据 ACE 抑制肽的结构特点,采用 Fmoc 固相 合 成 法( SPPS) 合 成 了 3 种 类 ACE抑制肽KVLPVF、KVLPVY、KVLPHY,研究不同的氨基酸残基位于 C-端时对多肽的 ACE 抑制活性的影响.
1 材料与方法
Fmoc-AA-Wang Resin、Fmoc-AA-OH、HOBt、HBTU、DIEA、TFA、TIS ; 茚三酮、哌啶、无水乙醚、DMF 均为市售分析纯试剂; ACE、HHL 购自美国 Sigma 公司; 马尿酸( 生物纯,上海晶纯试剂有限公司) ; 乙腈、甲醇( 色谱纯,天津四友精细化学品有限公司) .
FF210 型多肽固相合成管; Agilent 1200 高效液相色谱仪; LGJ-10 冷冻干燥机; Bruke Esquire-3000型离子肼液相色谱质谱仪; UV-2450 紫外-可见分光光度计.
以 Wang Resin 作为固相载体,Fmoc 保护的氨基酸 为 原 料,采用固相合成法[16,17],用 HOBT /HBTU / DIEA 混合试剂进行缩合,用体积比为 95∶2. 5∶ 2. 5 的 TFA / TIS / H2O 混合试剂把目标肽从王树脂上切割下来,即得到以 KVLPVP 为先导肽的类 ACE 抑制肽 KVLPVF、KVLPVY、KVLPHY.
ACE 抑制剂的活性检测方法主要有体外检测法和体内检测法[10,18],体外检测方法主要包括紫外分光光度法[10,19]、高效液相色谱法[10,20]等. 高效液相色谱法具有准确性好、灵敏度高等优点,所以得到广泛的应用[10,11]. 本文也采用高效液相色谱法测定类 ACE 抑制肽的体外抑制 ACE 活性.
在 ACE 的作用下,三肽 HHL 被催化分解为二肽 His-Leu 和马尿酸,缓冲溶液作为空白对照,当ACE 抑制剂加入以后,抑制了三肽 HHL 的分解,使马尿酸的生成量减少. 通过三肽 HHL 在加入 ACE抑制剂前后生成的马尿酸的峰面积的不同,得出ACE 抑制剂的活性大小,计算公式为:
IR = ( A-B) /A × 100% ( 1)
式( 1) 中 IR 为 ACE 抑制肽样品对 ACE 的抑制率( % ) ; A 为空白对照组中马尿酸的峰面积; B 为添加 ACE 抑制肽组中马尿酸的峰面积
ACE 溶液配制: 用1mL 0. 1mol /L 硼酸缓冲液( pH 8. 3,含 0. 3 mol /L NaCl) 溶解 0. 1 U 的 ACE,即得所需溶液. 配制 类 ACE 抑 制 肽 溶 液 ( 2. 0 mg /mL) : 用 1 mL0. 1mol /L 硼酸缓冲液( pH 8. 3,含0. 3 mol /L NaCl ) 溶解2. 0mg 多肽纯品,即可配制成一系列所需肽溶液. 配制 HHL 溶液( 5. 0 mmol /L) : 用10 mL 0. 1 mol /L 硼酸缓冲液( pH 8. 3,含 0. 3mol /L NaCl ) 溶解 0. 02167 g HHL,即配制成所需溶液. 配制马尿酸标准液( 1. 0 mmol /L) : 首先称 18. 0mg 马尿酸标准样品,将其溶解于适量双蒸水,然后定容到 100 mL,即得到标准品溶液. 配制反应液: 移取 40 μL ACE 抑制肽溶液 2. 0 mg /mL 多肽溶液,置于 1. 5 mL 离心管中,加入 ACE 溶液 30 μL,37 ℃下保温 5 min,再加入 HHL 溶液 80 μL,混合均匀后反应 60 min( 在 37 ℃ 恒温水浴槽中) ,最后加入 1. 0mol /L HCl 200 μL 中止反应,即配制成所需反应液.配制空白对照液: 将上述反应液中的 ACE 活性抑制肽溶液用40 μL 的0. 1 mol /L 硼酸缓冲液( pH 8. 3,含 0. 3 mol /L NaCl ) 代替即可.
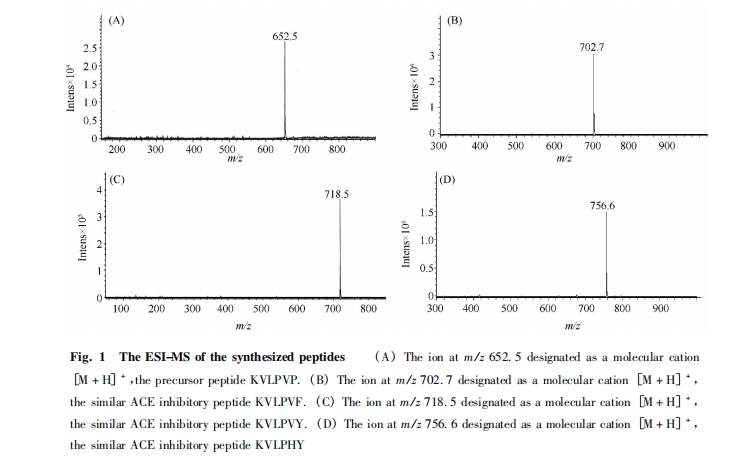
色谱条件为流动相: 乙腈/超纯水 = 50 /50 ( 各含 0. 05 % TFA) ,流速: 0. 6 mL /min; 检测波长: 228nm; 色谱柱: Agilent Eclipse XDB-C18( 4. 6 mm × 150mm,5 μm) ,柱温 25 ℃ ; 进样量: 20 μL.
2 结果
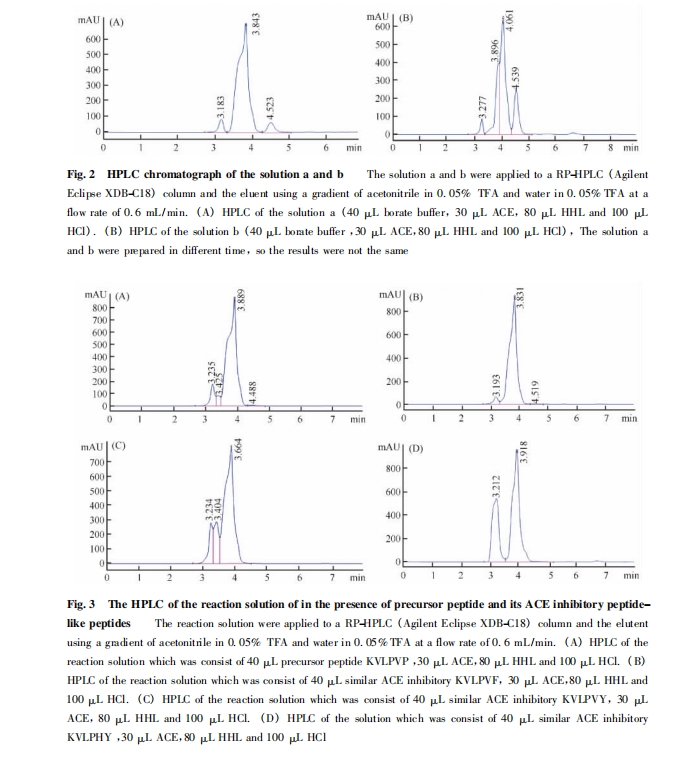
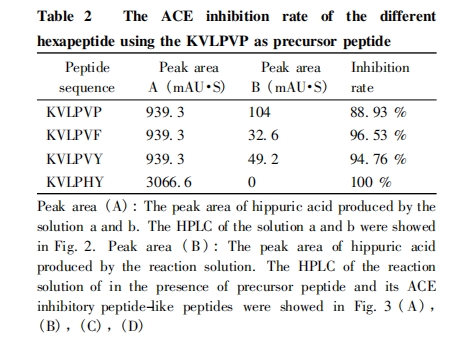
通过 Table 2 可以看出: 用芳香性的氨基酸残基Phe、Tyr、His 和疏水性的 Val 替换先导肽 KVLPVP中 C-端的氨基酸残基 Pro 后,相应的 ACE 活性抑制率都升高了,其中抑制作用最大的是多肽 KVLPHY,其抑制率达到 100% .
3 讨论
大多数 ACE 活性抑制肽目前都是采取天然分离提取的方法得到的[21,22]. 研究发现,ACE抑制肽的活性与氨基酸种类有关[7,9]. 由于天然提取的过程较为复杂,且提取的ACE活性抑制肽结构比较单一,不便于对其构效关系进行研究. 与天然提取方法不同,本文采用 Fmoc 固相合成法合成先导肽及其一系列类ACE抑制肽,经RP-HPLC 分离纯化并对其进行 ESI-MS 表征.结果表明是所需要的目标肽,这为活性研究提供了原料基础. 然后,利用RP-HPLC 法直接测定类 ACE 抑制肽的体外抑制 ACE活性,对比加入类 ACE 抑制肽与空白对照液的液相色谱图,可以看出多肽的加入对溶液中的ACE活性发生了不同程度的抑制作用. 这也表明,ACE 抑制肽的活性与其肽链C-端的氨基酸种类有着很大的关系. 通过 Table 2 中不同的 6 肽的ACE活性抑制率的比较,表明当先导肽 KVLPVP 的 C-端的氨基酸残基Pro被芳香性的氨基酸残基 Phe、Tyr、His 和疏水性 Val 替代后,类ACE抑制肽与ACE活性中心的结合作用力增强,其 ACE 活性抑制率提高且都高于先导肽,推测芳香性的氨基酸残基 Tyr 因其侧链上有具有亲核性的吲哚基,可以增强多肽与 ACE 活性中心 Zn2 + 的作用力. 尤其是His位于C-端时,ACE抑制活性更强,推测是位于 ACE 活性中心的Zn2 +与His 残基上的咪唑基与发生了配位作用,咪唑基在与 ACE 结合的过程中和缓激肽、血管紧张素 I 形成了竞争性作用,使 ACE 的催化活性降低,从而提高其 ACE 抑制活性.
ACE 活性抑制肽降压效果显著,同时能减少传统的降压药物所产生的不良反应,在治疗和控制高血压方面有着广阔的的应用前景. 基于以上不同的氨基酸残基位于 C-端时对多肽的 ACE 抑制活性影响的研究,可以为降血压药物分子的进一步设计和筛选提供了研究基础. 但对于 His 残基在肽链 C-端的具体位置以及它在肽中 C-末端的个数对肽链的ACE 抑制活性有什么影响,将在以后进行进一步的研究.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志