
摘 要 目的:制备细胞穿膜肽PFV修饰紫杉醇(PTX)/青蒿琥酯(ART)共载靶向胶束,并考察其体外抗肿瘤活性。方法:按前期优化的工艺,采用薄膜水化法制备PFV修饰PTX/ART共载靶向胶束,并对其进行表征。以空白胶束作为空白对照,采用磺基罗丹明B法评价PTX胶束、ART胶束、PTX/ART胶束以及PFV修饰PTX/ART共载靶向胶束对人胃癌BGC-823细胞的毒性;以香豆素作为荧光探针取代PTX,制成相应的不同胶束,采用流式细胞仪和荧光显微镜测定和观察BGC-823细胞对各胶束的摄取情况和靶向性;并通过Transwell小室法考察PTX胶束、ART胶束、PTX/ART胶束以及PFV修饰PTX/ART共载靶向胶束对BGC-823细胞侵袭的影响。结果:PFV 修饰 PTX/ART 共载靶向胶束的平均粒径为(51.30±3.95)nm,分散系数为 0.19±0.01,Zeta 电位为(0.21±0.02)mV,PTX、ART的包封率均高于90%,形态呈圆球形。空白胶束对BGC-823细胞无明显毒性,PTX胶束、PTX/ART胶束以及 PFV 修饰 PTX/ART 共载靶向胶束对 BGC-823 细胞的半数抑制浓度分别为(3.09±0.22)、(1.93±0.24)、(1.11±0.15)μmol/L;不同胶束在BGC-823细胞核中的分布数量排序依次为PFV修饰香豆素/ART胶束>香豆素/ART胶束>香豆素胶束>空白对照,抑制细胞侵袭作用的大小依次为 PFV 修饰 PTX/ART 共载靶向胶束>PTX/ART 胶束>ART 胶束>PTX 胶束>空白对照。结论:制备的PFV修饰PTX/ART共载靶向胶束符合《中国药典》要求;其对BGC-823细胞具有较强的细胞毒性,可提高药物的靶向性和细胞对药物的摄取能力,并能抑制肿瘤细胞的侵袭和转移。
胃癌是消化道肿瘤中发病率最高的恶性肿瘤[1]。目前,化疗是胃癌的主要治疗方式,但化疗后残余的癌细胞会通过侵袭作用导致肿瘤转移,且化疗药物会增加机体的毒副反应,导致患者预后较差[2]。紫杉醇(PTX)具有较高抗癌活性,在临床用于多种癌症的治疗,但溶解性低、生物利用度差、无选择分布是限制其临床应用的主要原因[3]。提高PTX的靶向性以降低其毒副作用并抑制肿瘤细胞转移显得尤为重要。细胞穿膜肽(简称“PFV”)具有细胞穿透能力强的特点,并且能增加药物在肿瘤部位的蓄积[4]。青蒿琥酯(ART)具有抑制肿瘤血管新生、抑制肿瘤侵袭转移、增敏抗肿瘤化疗药物的作用[5-7]。胶束具有粒径小和对机体毒性低等优点,可增加化疗药物的溶解度并提高化疗药物对肿瘤的被动靶向性[8-11]。为提高PTX的肿瘤靶向性及其对肿瘤细胞侵袭和转移的抑制作用,本课题组前期优化工艺后采用薄膜水化法制备了 PFV 修饰 PTX/ART 共载靶向胶束,其中PFV用来提高细胞对药物的摄取能力,PTX作为化疗药物,ART用来抑制肿瘤细胞的侵袭和转移[12]。本研究在前期研究基础上,对所制胶束进行表征后并进一步考察PFV 修饰 PTX/ART 共载靶向胶束的体外抗肿瘤作用,为胶束包载PTX的靶向给药和ART抑制肿瘤细胞侵袭和转移的相关制剂开发提供参考。
1 材料
1.1 仪器
FA1004 型电子天平(上海越平科学仪器有限公司);SG3300H型超声波清洗机(上海冠特超声仪器有限公司);RE52CS型旋转蒸发器(上海亚荣生化仪器厂);DZKW-S-4型恒温水浴锅(上海医疗器械公司医疗器械五厂);HBS-1096A型酶标仪(南京德铁实验设备有限公司);JEM-1200EX 型透射电镜(日本 Tokyo 公司);Ac-curi C型流式细胞仪(美国Becton Dickinson公司);ZS90型激光散射粒径测定仪(英国Malvern公司);WJ-80B-Ⅱ型细胞培养箱(上海新苗医疗器械制造有限公司);SW-CJ-1D型超净台(上海沪净医疗器械有限公司)。
1.2 药品与试剂
PTX原料药(批号:MB1178,纯度:≥99%)、ART原料药(批号:J0101A,纯度:≥98%)、TPGS1000(批号:MB2036)、胰蛋白酶、磺基罗丹明B(SRB)、青链霉素双抗;RPMI 1640培养基、胎牛血清(美国Gibco公司);Soluplus两亲性接枝共聚物(德国BASF公司);二硬脂酰基磷脂酰乙醇胺-聚乙二醇 2000-PFV(DSPE-PEG2000-PFV)修饰胶束的靶向材料由辽宁中医药大学药学院药剂实验室合成;三氯甲烷、甲醇等试剂均为分析纯,水为娃哈哈牌纯净水。
1.3 细胞
人胃癌BGC-823细胞购自中国医学科学院基础医学研究所。
2 方法与结果
2.1 胶束的制备
按照文献方法[12],精密称取 DSPE-PEG2000-PFV 1.5mg、ART 2 mg、Soluplus 60 mg、TPGS1000 12 mg、PTX 0.5mg于50 mL圆底烧瓶中,加5 mL三氯甲烷使溶解,然后在40 ℃水浴下减压旋转蒸发除去三氯甲烷。待烧瓶底部形成一层均匀白色膜时,加入磷酸盐缓冲液(PBS,pH 7.4)5 mL,在35 ℃水浴下振摇11 min,再以微孔滤膜(0.22 μm)滤过 2 次,随后将滤过的胶束溶液转移至 5mL量瓶中,以PBS定容至刻度,即得PFV修饰PTX/ART共载靶向胶束。同时,按照上述方法制备空白胶束(空白对照)、PTX胶束、ART胶束和PTX/ART胶束,其中空白胶束只添加处方量的 Soluplus 和 TPGS1000,PTX 胶束只添加处方量的 Soluplus、TPGS1000和 PTX,ART 胶束只添加处方量的Soluplus、TPGS1000和ART,PTX/ART胶束只添加处方量的Soluplus、TPGS1000、ART和PTX。
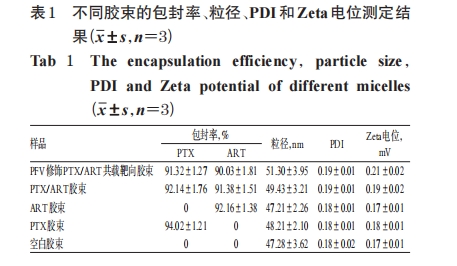
2.2 胶束的表征

2.3 细胞培养
将 BGC-823 细胞接种到含 1%青链霉素和 10%胎牛血清的RPMI 1640培养基中,在37 ℃、5% CO2条件下培养(下同)。第2天换液,隔天传代,采用4~6代细胞进行细胞试验。
2.4 胶束对BGC-823细胞的毒性作用考察

2.5 BGC-823细胞对胶束的摄取情况考察
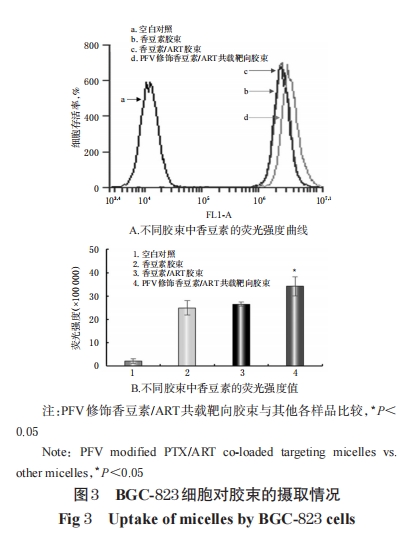
以香豆素作为荧光探针考察细胞对胶束的摄取情况。以香豆素代替PTX,按“2.1”项下方法制备香豆素胶束、香豆素/ART胶束、PFV修饰香豆素/ART共载靶向胶束(香豆素的含量均为2 μmol/L[3],其余药物和辅料的用量不变),并同时制备空白胶束作为空白对照。取对数生长期BGC-823细胞接种至6孔板中(2.5×105个/孔),分为不同胶束给药组,先用不含药的培养基培养24 h后,弃培养基,然后加入新鲜含药培养基[180 μL/孔,其中胶束给药量均为20 μL/孔(含药胶束中ART浓度均为100μmol/L)],继续培养 3 h。然后以 PBS 洗板,以 0.25%胰蛋白酶消化细胞后加入 0.5 mL PBS。采用流式细胞仪测定各组细胞荧光强度,该值越大,说明细胞对胶束的摄取越多。
2.6 胶束对BGC-823细胞的靶向性考察
以香豆素作为荧光探针考察胶束的靶向性。以香豆素代替PTX,按“2.1”项下方法制备香豆素胶束、香豆素/ART胶束、PFV修饰香豆素/ART共载靶向胶束;同法进行细胞分组、给药,继续培养3 h后,以PBS洗板,加入4%多聚甲醛固定细胞8 min,在避光处用Hoechst 33258对细胞进行染色。采用荧光显微镜观察细胞中药物的分布情况,其中蓝色荧光区域代表BGC-823细胞核,绿色荧光区域代表香豆素,蓝绿色荧光区域为细胞与香豆素分布的叠加处。

2.7 PFV 修饰 PTX/ART 共载靶向胶束对 BGC-823 细胞侵袭的影响
采用Transwell小室法进行测定。按“2.1”项下方法分别制备空白胶束(空白对照)、PTX 胶束、ART 胶束、PTX/ART 胶束和 PFV 修饰 PTX/ART 共载靶向胶束,各含药胶束中 PTX 浓度均为 10 μmol/L,ART 浓度均为100 μmol/L。取对数生长期BGC-823细胞,以0.25%胰蛋白酶溶液消化后,接种在 Transwell 小室中(1.5×105个/孔),分为不同胶束给药组,各小室中加入相应含药培养基[200 μL/室,给药量为20 μL/室]。在24孔板中加入含 10%胎牛血清的培养基(700 μL/孔),将上述 Transwell小室放在24孔板中培养10 h后,用棉球擦去小室中未侵袭的细胞,并用4%多聚甲醛固定小室下方侵袭的细胞25 min,然后用0.1%结晶紫染色15 min。采用显微镜观察,并随机选取1个视野拍照,镜下紫色信号的强度与侵袭通过小室基底膜的细胞数量成正比。

3 讨论
近年来,胶束作为化疗药物的运送载体在抗肿瘤方面的应用受到越来越多的关注,其疏水嵌段组成的聚合物胶束内核能够为难溶性药物提供贮藏空间,而疏水性化疗药物的溶解度也在亲水外壳的共同作用下明显提高[8]。基于此,本课题组将化疗药PTX和ART共同包埋于胶束内,使这两种药物达到协同增效的目的。PFV是一种疏水性的电中性短肽,经PFV修饰的脂质体等递药系统能明显增加细胞对药物的摄取[4]。本课题组前期通过酰化反应合成了DSPE-PEG2000-PFV,其可嵌入胶束中使PFV修饰于胶束外周。本研究制备的PFV修饰PTX/ART 共载靶向胶束呈圆球形,粒径在 51 nm 左右,有良好的粒径分布和形态,药物的包封率均大于90%,符合2015版《中国药典》(四部)的要求[13]。
体外细胞毒性试验中,PTX 的终浓度设置为 10μmol/L是为了保证在杀伤肿瘤细胞的前提下,还能保证本研究各项试验中有足够的细胞存活量;在 ART 的Transwell 小室预试验中,当 ART 的浓度为 100 μmol/L时,恰能抑制细胞的侵袭和转移,因此本研究在胶束的处方中设置 ART 的浓度为 100 μmol/L。本研究结果显示,空白胶束对BGC-823细胞无明显细胞毒性,这提示胶束膜材安全性较高,可作为运送药物的载体[14]。PFV修饰 PTX/ART 共载靶向胶束中 PTX 浓度为 0.63~10μmol/L时,与其他胶束样品比较具有更强的细胞毒性。
因 PTX 和 ART 都不具有荧光活性,所以在细胞摄取和胶束靶向性试验中,本课题组选择具有荧光活性的香豆素作为探针药物。香豆素作为荧光探针在研究脂质体等给药体系的药物摄取情况中已有运用,具有简便、易操作的特点[15]。本研究通过流式细胞仪和荧光显微镜对PFV修饰香豆素/ART共载靶向胶束进行定量和定性考察,发现香豆素的荧光强度在PFV修饰胶束组细胞中显著增强,表明PFV修饰后可增加载药胶束在肿瘤细胞中的分布,提高了药物的肿瘤靶向性,并增强了肿瘤细胞对药物的摄取。此外,本研究通过细胞侵袭试验发现,载有 ART 的胶束均呈现出对细胞侵袭的抑制作用,这表明 ART 的加入可抑制 BGC-823 细胞的侵袭和转移。
综上所述,本研究成功制备了 PFV 修饰 PTX/ART共载靶向胶束,其具有较强的细胞毒性,能提高药物的肿瘤靶向性和细胞对药物的摄取能力,并且可抑制肿瘤细胞的侵袭和转移。但由于试验均在体外完成,并不能代表体内结果,在接下来的研究中,笔者将进一步展开PFV 修饰 PTX/ART 共载靶向胶束的体内抗肿瘤作用研究。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志