
摘 要 目的:探索自组装短肽RAD16-Ⅰ构建抗肿瘤药物原位水凝胶的可能性。方法:采用流变仪测量含与不含抗肿瘤药物紫杉醇的0.1%、0.2%、0.5% RAD16-Ⅰ水溶液与等体积的磷酸盐缓冲液(PBS)混合前后的储存模量(G′)、损耗模量(G″)、相位角(Δ)等流变学参数;通过倒置显微镜观察含与不含紫杉醇的RAD16-Ⅰ水溶液加入乳腺癌MDA-MB-435S细胞的培养基后形成的水凝胶状态及对细胞形态的影响(与紫杉醇水溶液比较)。结果:在含与不含紫杉醇的RAD16-Ⅰ水溶液中,G′近似或略大于G″,随RAD16-Ⅰ浓度增加G′和G″变化很小;与不加PBS比较,加入PBS后G′显著增加且呈浓度依赖性,G″也有增加但增加幅度比G′要小很多,Δ显著变小。含紫杉醇的RAD16-Ⅰ溶液在细胞培养基中能形成并保持水凝胶状态,水凝胶与同浓度紫杉醇水溶液作用于细胞相同时间后的细胞形态基本相同。结论:含紫杉醇的RAD16-Ⅰ水溶液可在模拟生理条件下形成水凝胶,并保持凝胶状态和紫杉醇固有的抗肿瘤作用。
抗肿瘤药物给药的方法和途径除常用的口服和静脉用药外,还可以局部或腔内给药。为了提高肿瘤区域的药物浓度,肿瘤局部给药系统的研究方兴未艾[1-3],研究的重点主要集中在提高疗效和降低不良反应方面[4-5]。近年来,用作药物载体材料的释药特征[6]、对主药活性的影响[7]以及所构建的给药系统的生物安全性[8]也为许多实验研究所关注。离子互补型自组装短肽作为新型生物材料,由于其基本结构简单可控且具有良好的自组装特性和生物相容性,得到许多领域研究者的注意[9-10],探讨自组装短肽以混悬液、水凝胶等形式被开发为药物载体的研究是其中颇具特色的部分[9,11]。已有研究表明,离子互补型自组装短肽RAD16-Ⅰ不仅能作为胶体稳定剂使水难溶性药物在水中相对稳定地存在,而且在体液离子强度和(或)pH条件下能够迅速形成具有一定机械强度的水凝胶,显示了其具有成为原位水凝胶药物载体的潜力[12-13]。本研究采用临床常用且疗效显著的抗肿瘤药物紫杉醇(PAC)作为模型药物[14],初步探讨以自组装短肽RAD16-Ⅰ构建抗肿瘤药物原位水凝胶载体的可能性。
1 材料
1.1 仪器
AR200ex 流变仪(美国 TA 公司);CKX41-A32PH 倒置相差显微镜(日本Olympus公司);TGW16离心机(长沙英泰仪器有限公司,离心半径:12 cm)。
1.2 药品与试剂
RAD16- Ⅰ(Ac-RADARADARADARADA-CONH2,纯度:≥98%,制成1%(m/V)的水溶液,临用前稀释为所需浓度);PAC(中国食品药品检定研究院,批号:100382-201102,供含量测定用);L-15培养基、胎牛血清、双抗(100 u/ml的青霉素和100 μg/ml链霉素,使用时稀释100倍)、胰酶细胞消化液 0.25%Trypsin-EDTA(美国 Invitrogen公司);牛胰岛素(美国Sigma公司);水为超纯水,其余试剂为分析纯。
1.3 细胞
乳腺癌MDA-MB-435S细胞(四川大学纳米生物医学与膜生物学研究所保存)。
2 方法与结果
2.1 含与不含PAC的RAD16-Ⅰ水凝胶的黏弹性特征
将1%的RAD16-Ⅰ水溶液稀释制成0.1%、0.2%、0.5%的RAD16-Ⅰ水溶液。将1%的RAD16-Ⅰ水溶液和PAC水溶液(1.75 μg/ml)稀释制成含PAC的不同浓度(0.1%、0.2%、0.5%)的RAD16-Ⅰ水溶液。取上述水溶液分别与等体积磷酸盐缓冲液(PBS)混合,采用流变仪测量混合前、后的储存模量(G′)、损耗模量(G″)和相位角(Δ)。测量用夹具直径20 mm,不锈钢锥板锥度1 °,平截25 μm,应变设为固定的0.5%,频率扫描时频率范围为0.1~100 Hz,时间扫描时频率为1.0 Hz,加盖防止溶液挥发,帕耳贴板控温系统控制温度为 25 ℃,每次测量用70 μl 样品。含与不含 PAC 的 RAD16-Ⅰ水凝胶的黏弹性特征测定结果见表1。
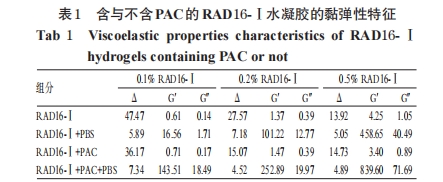
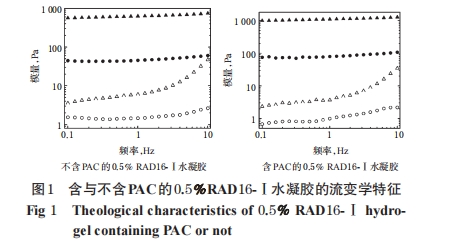
从图1中可以看出,未加入PBS之前,溶液的G′在频率达到1 Hz后随频率增加急剧增加,而加入PBS之后,在10 Hz以下,G′随频率变化的幅度都很小,且在不同频率下G′远大于G″。
2.2 细胞培养基中含与不含PAC的RAD16-Ⅰ水凝胶的形态特征及抗肿瘤效果
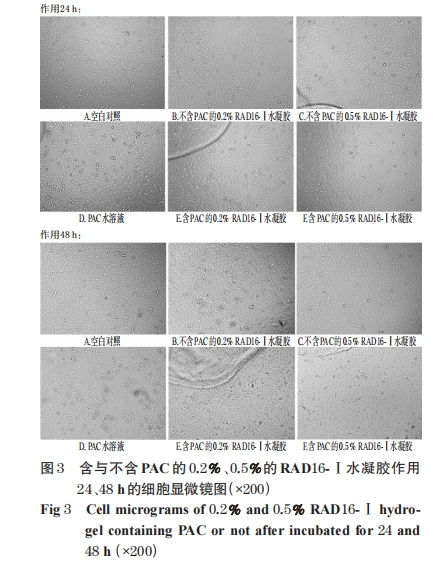
MDA-MB-435S细胞贴壁达80%时,胰酶消化,离心(135×g,5 min),细胞计数,细胞终浓度为1×104/孔。接种于96孔板,置于37 ℃下培养,在分别培养1 d后,更换培养基,分别加入含与不含PAC(75 nmol/L)的不同浓度(0.2%、0.5%)的RAD16-Ⅰ水凝胶或PAC溶液(75 nmol/L),置于培养箱中培养。分别于24、48 h后观察水凝胶的形状、透明程度、凝胶状态的维持情况以及不同给药情形下培养基或水凝胶中肿瘤细胞的细胞密度、细胞形状,同时设不加药物的空白对照进行比较。含与不含PAC的0.2% RAD16-Ⅰ水凝胶作用24 h的细胞显微镜图见图 2,含与不含 PAC 的 0.2%、0.5% RAD16-Ⅰ水凝胶作用 24、48 h的细胞显微镜图见图3。
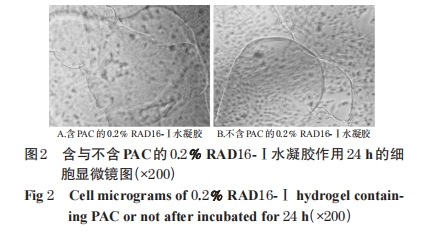
由图2可知,含与不含PAC的RAD16-Ⅰ溶液均能在培养基中形成水凝胶,水凝胶呈透明的膜片状;在未更换培养基的情况下,水凝胶与细胞共处24 h时仍然很好地保持其存在的状态。由图3可知,从细胞密度、细胞形状等方面对比,含PAC水凝胶的培养基中细胞生长状况与加入PAC水溶液的培养基中细胞生长状况相似,提示水凝胶形成后保持了其中所加载药物PAC固有的抗肿瘤效果。
3 讨论
水溶液具有的黏弹性,可用G′和G″的大小和对频率的依赖性来表征[15-16]。G′代表材料的弹性特征,此值增加意味着材料特性更接近于弹性固体;G″代表材料的黏性特征,此值增加意味着材料特性更接近于黏性液体;Δ的正切等于G″/G′,其值的增加意味着材料在相对黏弹性上趋向于黏性液体。本研究中流变学参数测定结果表明,含与不含PAC的RAD16-Ⅰ水溶液在与PBS接触前表现为更接近于黏性液体的行为特性,与PBS接触后表现更接近于标准的弹性体行为,表示溶液中粒子间相互缔合、缠结作用较强,已处于聚集状态,表现出一定的机械强度;较低频率时呈现出显著的弹性且随频率变化不明显,表明水溶液中形成了典型的交联网络结构。这提示RAD16-Ⅰ在接触到 PBS 后能够迅速形成具有一定机械强度的水凝胶。由于PBS 能基本模拟体液中的离子强度和pH 情况,所以上述实验显示的RAD16-Ⅰ的动态黏弹流变性能表明RAD16-Ⅰ具有成为PAC等抗肿瘤药物原位水凝胶载体的潜力。
原位水凝胶作为药物载体需要形成的水凝胶在目的作用部位以一定的形状保持足够的时间,以保证所加载药物的缓控释作用发挥。观察水凝胶在有细胞生长的培养基中的存在状态和保持时间,以及细胞的形状和生长状况,可以简单、直观地初步表征这种原位水凝胶在体内应用的可能性。本试验结果显示,不同浓度的含与不含PAC的RAD16-Ⅰ水溶液均能在模拟生理条件下形成透明的膜片状的凝胶并维持相当时间,且细胞生长状况对比提示水凝胶形成后保持了其中所加载药物PAC固有的抗肿瘤效果。
本研究初步表明了自组装短肽构建抗肿瘤药物原位水凝胶并在体内应用的可能性。离子互补型自组装短肽属于具有高度生物相容性的生物可降解合成生物材料,可以利用其在肿瘤组织原位形成亲水性凝胶而作为抗肿瘤药物载体。后续研究需要进一步开展深入的细胞和动物实验以充分验证其可行性。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志