
摘 要 目的:从环二肽及其衍生物抗肿瘤活性的研究中,归纳最具发展前景的抗肿瘤药物的研发方向。方法:以“环二肽”“真菌中环二肽”“环二肽衍生物”“抗肿瘤活性”和“海洋微生物”等组合作为关键词,查阅1984-2013年在Medline、ACS、Sciencedirect、中国知网全文数据库、万方数据库和维普中文期刊数据库中关于来自真菌中的环二肽及其衍生物的研究成果,对其抗肿瘤生物活性进行综述。结果与结论:已发现的环二肽有35种、环二肽衍生物有47种。来自海洋真菌类中的环二肽具有抗肿瘤活性,同一种环二肽对不同肿瘤细胞表现出不同强弱的毒性活性,体现了环二肽对肿瘤细胞的选择性;含脯氨酸和缬氨酸的环二肽生物活性较强,具有较好的抗肿瘤药物开发前景。环二肽衍生物比简单结构的环二肽抗肿瘤活性更强,如环二硫哌嗪二酮类化合物、含色氨酸的异戊烯化的环二肽类化合物毒性较强,含亮氨酸的衍生物抗氧化性较强,含苯丙氨酸的环二肽衍生物Phenylahistin已开发为抗肿瘤药物。
近年来,人们在筛选抗肿瘤药物研究方面取得了较大进展,特别是环二肽类(CDPs)化合物得到了医药工作者的极大关注。多肽和蛋白质构成不同类别的内源性化合物,这些化合物调节着生物体的多种重要的生物功能,以维持体内环境的稳态平衡,而一些由微生物产生的多肽则具有药理学意义[1]。其中,环肽类(CPs)是多肽类的一种,在生物学中发挥着重要作用。CPs具有内在的结构优势,如稳定性(抗酶促降解)、刚性构象、改进受体部位的选择性和药理特异性等[2]。环四肽[3]和环六肽类化合物茜草科型环肽[4]均具有抗肿瘤活性。CDPs属于一种结构最简单的CPs化合物,其是由两个氨基酸通过肽键环形成的,其典型结构中包含一个二酮哌嗪。由于CDPs具有特别稳定的六元环结构和构象约束作用,在药物化学研究中是一类重要的药效团[2,4]。另外,CDPs的来源呈多样性,在各种食品和饮料中都能发现,也能从海洋真菌中分离出来[5]。由于来源不同,CDPs 的生物活性也不尽相同,其中有一些CDPs具有明显的抗肿瘤作用。由文献可知,国内学者大多停留在从不同菌株中寻找、发现新 CDPs 的研究阶段[4,6-10],对其药理毒性研究的并不多[11-12],而国际上大多学者则主要研究CDPs及其衍生物的药理作用[5,13-15]。本文拟以“环二肽”“真菌中环二肽”“环二肽衍生物”“抗肿瘤活性”和“海洋微生物”等组合作为关键词,查阅 1984-2013 年在 Medline、ACS、Sciencedirect、中国知网全文数据库、万方数据库和维普中文期刊数据库中关于来自真菌中的CDPs及其衍生物的研究成果,对其抗肿瘤生物活性进行综述。结果,共查阅到相关文献112篇,剔除83篇,得到有效文献28篇。经整理,已发现的CDPs有35种、CDPs衍生物有47种,现综述如下。
1 真菌中的CDPs抗肿瘤生物活性
CDPs 一般具有两个氨基酸围绕在二酮哌嗪环上的结构。从理论上来说,目前常见的 20 种氨基酸可构成很多种CDPs化合物,但实际发现的就数十种。王卫宁等[16]对这20种氨基酸作了太赫兹光谱及其分子结构的相关性研究,揭示了不同氨基酸之间的结构差异,依次是丙氨酸(Ala)、天冬氨酸(Asp)、天冬酰胺(Asn)、精氨酸(Arg)、胱氨酸(Cys)、谷氨酸(Glu)、谷氨酰胺(Gln)、甘氨酸(Gly)、组氨酸(His)、异亮氨酸(Ile)、赖氨酸(Lys)、亮氨酸(Leu)、蛋氨酸(Met)、苯丙氨酸(Phe)、脯氨酸(Pro)、丝氨酸(Ser)、苏氨酸(Thr)、酪氨酸(Tyr)、色氨酸(Trp)和缬氨酸(Val),其中有些氨基酸性质活泼,如苯丙氨酸、丙氨酸、甘氨酸、亮氨酸、脯氨酸、缬氨酸等,能形成较多的CDPs;有些则较弱,如精氨酸、组氨酸、蛋氨酸、苏氨酸等出现的频次则很少。
从已发现的 CDPs 的生物活性来看,来自真菌中的 CDPs具有一定的抗肿瘤活性,特别是来自海洋的真菌类。由于海洋微生物生活在低温、高压、寡营养、高盐的海洋环境,能产生出结构新颖多样、活性独特的天然产物。目前,从海洋细菌、海洋放线菌、海洋真菌、红树林叶内生真菌的代谢产物中已分离出大量的CDPs化合物[17]。下面就主要的几种CDPs的抗肿瘤活性分别进行介绍。
1.1 含脯氨酸CDPs的抗肿瘤活性
含脯氨酸的CDPs具有普遍的生物活性,且有较强的抗肿瘤作用。目前已发现约有12种含脯氨酸环的二肽化合物,其中有10种抗肿瘤作用明显,例如环(脯-缬)二肽在质量浓度为50 μg/ml时对前列腺癌细胞的生长抑制率约为53%,对肝癌细胞的抑制率约为 17%[10]。环(苯丙-脯)二肽在质量浓度为 10μg/ml时对癌细胞生长抑制率约为50%,且对结肠癌细胞、乳腺癌细胞和宫颈癌细胞等也有明显的抑制能力[14]。环(甘-脯)二肽在质量浓度为50 μg/ml时对前列腺癌细胞的生长抑制率约为34%,对肝癌细胞的抑制率约为16%[15]。环(组-脯)二肽、环(亮-脯)二肽、环(脯-脯)二肽、环(脯-酪)二肽和环(脯-苏)二肽等对乳腺癌、宫颈癌和结肠癌也有抑制作用,同时还有免疫活性、调节激素及调控能量代谢的作用。但也有两种含脯氨酸CDPs的生物活性不明或没有,如环(丙-脯)二肽和环(异亮-脯)二肽。
1.2 含亮氨酸或异亮氨酸CDPs的抗肿瘤活性
含异亮氨酸的CDPs约有6种,其中有5种具有较强的抗肿瘤作用,如环(异亮-亮)二肽在质量浓度为50 μg/ml时对前列腺癌细胞的生长抑制率约为43%,对肝癌细胞的抑制率约为32%;环(异亮-苯丙)二肽对前列腺癌细胞的生长抑制率约为27%[11]。含亮氨酸CDPs 约有7种,其中有3种有抗肿瘤活性,但与含异亮氨酸CDPs相比,其生物活性较弱,如在质量浓度为5 μg/ml时对小鼠乳腺癌细胞的实验表明,环(丙-亮)二肽的抑制率约为(13.1±5.3)%;环(丙-异亮)二肽具有体外抗肿瘤活性,抑制率约为(13.8±0.5)%[11];环(亮-脯)二肽对乳腺癌、宫颈癌和结肠癌细胞有较弱的抑制作用。
1.3 含缬氨酸CDPs的抗肿瘤活性
含缬氨酸CDPs约有7种,其中5种具有较强的抗肿瘤作用,2种生物活性不明。如环(苯丙-缬)二肽、环(脯-缬)二肽和环(缬-缬)二肽在质量浓度为50 μg/ml时对前列腺癌细胞的生长抑制率分别为50%、52%和36%,而对肝癌细胞的抑制率分别为31%、17%和10%[10]。
1.4 真菌中CDPs对肿瘤细胞具有选择特性
一般来说,选择性包含两个含义,一是指同一种CDPs对于不同肿瘤细胞表现出不同的毒性效果,二是指同一种肿瘤细胞对于不同CDPs表现出不同的生物活性。如含脯氨酸的CDPs和含缬氨酸的CDPs明显对前列腺癌细胞具有很强的抑制作用,但对肝癌细胞的抑制效果就差一些。由此说明,CDPs不具有广谱抗肿瘤作用,其毒性作用对细胞的选择性较强。
2 CDPs衍生物的抗肿瘤活性及抗氧化活性
2.1 CDPs衍生物的抗肿瘤活性
CDPs 的基本结构中,含有两个氢键给体和两个氢键受体。氢键是药物与受体相互作用的主要方式,也是与其他化学成分合成更大药效基团的关键。新合成的CDPs衍生物常常具有更加明显的生物活性,成为新药研发的主要方向。
Gardiner DM等[18]、Williams DE等[19]在青霉菌、曲霉菌、粘帚霉菌、嗜热子囊菌和念珠菌等真菌中发现了一类结构高度修饰的有毒CDPs化合物,即环多硫哌嗪二酮类物质。最常见且最稳定的环多硫哌嗪二酮类化合物是环二硫哌嗪二酮类化合物,这类化合物中含有胶霉毒素。胶霉毒素最早来源于缨粘帚霉的次生代谢产物,可引起细胞凋亡,可能是癌症等疾病的潜在治疗药物。胶霉毒素质量浓度为0.15 mg/L就有明显的细胞毒活性,对小鼠乳腺癌细胞(tsFT210)增殖的抑制率为99.1%[20]。
焦曲霉有一种代谢物是(-)-Phenylahistin(PLH),其由 L-苯丙氨酸和含异戊烯基的脱氢组氨酸构成,具有细胞毒性,对细胞循环有抑制作用。有学者通过研究 PLH 的异构体(-)-PLH和(+)-PLH对于8种癌细胞(见表1)的生物活性,结果发现(-)-PLH 比(+)-PLH 对癌细胞的毒性效果要强很多[半数抑制浓度(IC50)值越低,毒性越强][13]。Nereus 公司已于2002年将PLH开发为临床抗肿瘤药物。
某些含酪氨酸的CDPs衍生物具有一些特殊的生物活性,如环(亮-酪)二肽对荷兰猪缺血后心肌功能障碍有很好的保护作用[21];环(4-羟基-脯-苯丙)二肽的体外抗乳腺癌活性,抑制率可达(48.3±3.3)%。香港红树林内生真菌的次级代谢产物Cyclo-(D-Leu-Gly-L-Tyr-L-Val-Gly-S-O-Leu),对乳腺癌细胞具有较弱的细胞毒作用[21]。
2.2 CDPs衍生物的抗氧化活性
Tadashi F等[13]于2012年研究发现,含亮氨酸的CDPs衍生物具有很强的抗氧化活性(见表2),共有20种CDPs 衍生物,其中约有一半对氢氧自由基的抗氧化活性约为66%~97.8%,比维生素E的抗氧化作用要强2~3倍,但只有含胱氨酸的环(胱-亮)二肽具有对氧自由基的抗氧化活性,约为83%,比维生素E抗氧化作用高出近2倍多。

3 具有抗肿瘤作用的CDPs的主要来源
尽管 CDPs 广泛存在于各种真菌、细菌、植物、无脊椎动物、脊椎动物和人体中[14],但是具有抗肿瘤活性的CDPs来源并不多,目前知道得最多的来自真菌中,而真菌菌株最丰富的地方是海洋环境。到目前为止,人们进行了大量的研究工作,从来自海洋真菌的代谢产物中已分离出大量的CDPs化合物。
3.1 从海洋真菌、细菌等中获得CDPs化合物
姚遥等[6]于2012年从南海采集的海泥中分离得到的海洋真菌 Penicillium sp,再次分离得到 3 种 CDPs 化合物:环(亮-缬)二肽、环(亮-异亮)二肽和环(异亮-缬)二肽。
吴一书等[12]于 2013 年从海洋小红酵母菌中分离获得环(亮-异亮)二肽,对抗氧化(DPPH)自由基的清除率达73.76%,对人肝肿瘤细胞、大鼠肾上腺嗜铬细胞瘤细胞、组织细胞淋巴瘤的IC50值分别为0.538、0.635、0.437 μmol/ml。Yang L等[22]于2003年从海洋沉积物中的喜盐芽孢杆菌的代谢物中提取出了一系列CDPs,其中有2种CDPs对前列腺癌细胞有抑制作用。
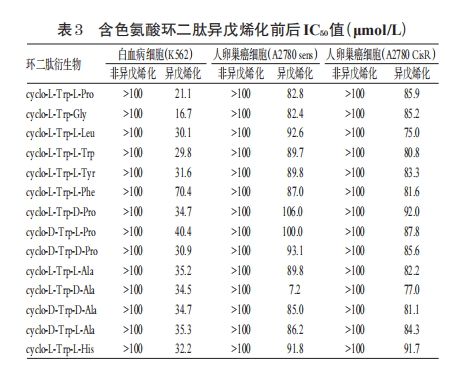
3.2 从植物真菌等中获得CDPs化合物
李春艳等[11]从红树林真菌草酸青霉中分离出了6个CDPs化合物,分别是环(苯丙-异亮)二肽、环(苯丙-缬)二肽、环(异亮-亮)二肽、环(缬-缬)二肽、环(脯-缬)二肽、环(脯-甘)二肽、环(脯-缬)二肽,其中环(苯丙-缬)二肽、环(异亮-亮)二肽和环(脯-缬)二肽对前列腺癌细胞有较好的抑制作用。还有学者[15]从红树林真菌泡盛酒曲霉中的分离出了4个CDPs,分别是环(异亮-缬)二肽、环(亮-缬)二肽、环(亮-异亮)二肽和环(亮-亮)二肽,其中只有环(亮-异亮)二肽具有抗肿瘤作用。
李春远等[9]利用波谱技术从红树科木榄内生真菌中首次分离得到了2个CDPs化合物,分别是环(甘-苯丙)二肽、环(苯丙-酪)二肽,其生物活性有待进一步研究。
还有一些学者研究了其他来源的CDPs,但与抗肿瘤活性有关的报道较少[23-28],其抗肿瘤活性目前尚不清楚。
4 结语
综上所述,海洋环境是真菌CDPs的主要来源,其中一些CDPs 具有抗肿瘤活性,如含脯氨酸或缬氨酸的CDPs 具有较强的生物活性。真菌中的CDPs还对不同癌细胞表现出不同的选择性。
CDPs衍生物具有实际药学研究靶向,这类化合物比常规CDPs的生物活性更强。含亮氨酸、苯丙氨酸、羟基脯氨酸、色氨酸的异戊烯化物以及环二硫哌嗪二酮类化合物都是很有前景的抗肿瘤、抗氧化药物的研发方向。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志