
摘要: 肽适体是一种从随机氨基酸的肽文库中筛选出来 ,可以高亲合力地与靶物质特异性结合的短肽序列. 它的主要结构包括恒定的展示支架蛋白及通过两端限制性插入的高变肽环. 酵母双杂交技术常用于筛选针对细胞内特异性靶蛋白的肽适体过程 ,筛选出的肽适体通过特异性结合识别靶标发挥类似“干扰基因”的作用从而影响蛋白的生物学活性.
适体 (aptamer) 源于拉丁语 aptus ,即配对、适应之意 , 是 利 用 指 数 富 集 配 体 的 系 统 进 化 技 术( systematic evolution of ligands by exponentialenrichment ,SELEX) 从含有大量序列的随机文库中 ,通过多次循环选择富集 ,获取所需要的特定结构或功能的生物适配子. 它具有库容量大、筛选范围广、与靶物质亲和力高、特异性强等优点 ,并以其稳定、易修饰等优于抗体的特性在基础研究、临床诊断、药物研制方面得以广泛应用.
肽适体(peptide aptamers , pepaptamers)是一种具有与核苷酸适体相类似性质的短肽序列:即利用 SELEX技术从人工合成的随机氨基酸肽文库中筛选出的可特异性、高亲合力结合靶物质的复合蛋白[1]. 并通过与靶物质识别结合 ,发挥其特定的生物学功效.
1 肽适体的功能基础
肽适体也可称为诱饵 (decoys) 或化学抗体分子(chemical antibodies) ,是一种新近出现的生物功能性分子[2 ]. 最早对于肽适体的设计灵感来源于免疫球蛋白和 T细胞受体所共有的保守区框架结构和高度特异性的可变区肽段结构. 其设计原理是将大量人工合成的随机肽序列插入、整合于蛋白支架 (proteinscaffolds) 之上 , 利用随机区域的信号模序 (signalmotif) 与特异性靶蛋白之间的相互作用 ,通过多元化的分子生物学展示技术 (display technique) ,筛选得到针对靶蛋白的高亲和力、高特异性的肽适体. 它是一类能在体内以特定三级结构稳定存在的短肽序列 ,高度可变的功能性结构域 (functional structuredomain ) 是筛选的物质基础. 随机序列可变区域与支架蛋白两端相互作用的识别、融合位点构成了肽适体的双重限制性 ,有利于筛选后的修饰、变构[3 ]. 与自然存在的氨基酸肽片段相比 ,人工合成的肽适体只包含单一变量的肽环 (loop) 结构 ,且两端的连接限制性也不依赖于二硫键 ,而是利用支架蛋白残基的定义位点相互识别连接的 ,有利于提高在机体内的稳定性[4 ](Fig. 1 ) .
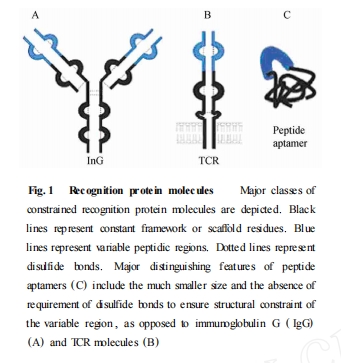
2 肽适体的筛选原理及技术路线
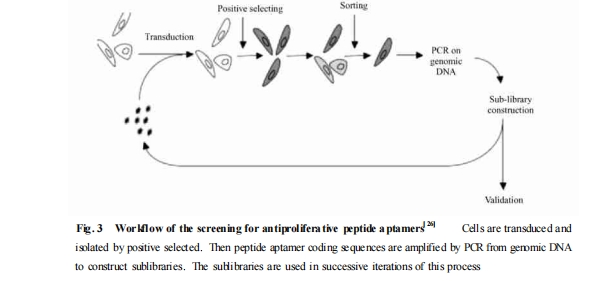
肽适体的筛选流程是一种遵循严格限制性的模块式的进化富集过程. 目前主要有 3 种生物学展示方法用于筛选 :利用酵母双杂交技术从细胞内筛选出能与作为“鱼饵”的蛋白靶物质特异性识别的肽适体 ,方法简便、快捷[5 ];通过噬菌体展示技术优化抗体、蛋白或是针对活细胞的肽适体筛选[6 ];采用逆转录病毒展示系统建立多种细胞表型相关蛋白的筛选平台[7 ]. 现就以目前使用最广泛的酵母双杂交系统为例介绍肽适体的筛选过程.
首先 ,构建氨基酸肽文库 :将一段长度约为 60bp 的随机寡核苷酸片段插入编码支架蛋白的开放阅读框 ,利用两端的高度限制性互相识别融合 ,使质粒载体转导后可以稳定表达含有大约 20 个随机氨基酸序列的支架蛋白2肽文库复合物 (Fig. 2) . 理论上 ,20 个随机氨基酸序列可通过工程菌株产生约2 ×10的8次方个不同肽段结构的克隆子 ,作为筛选特异性靶分子的初级文库. 通过不同的修饰可提高肽适体的稳定性 ,增加生物利用度 ,如在编码肽适体的侧翼序列处引入连接蛋白转导域 (protein transductiondomain ,PTD) ,有利于肽适体在筛选过程中的外源性摄取[9 ]. 目前 ,最常见的 PTD 是来源于 HIV2TAT 蛋白的携带正电荷的编码序列[10 ],它可与质膜表面携带负电荷的硫酸肝素葡聚糖相互作用介导融合蛋白的细胞内摄[11-13 ].

3 肽适体的特性
3. 1 肽适体多元生物活性
与基因敲除、RNA 干扰技术[16 ] 相比 ,肽适体以其精细的调控机理在研究各条信号转导途径中引起广泛的关注. 它对同源靶物质具有极高的特异性 ,因此可用于区分同一蛋白家族的不同成员 ,甚至是不同等位基因变异产生的异构体 ,其作用的机制为封闭蛋白的聚合位点 ,抑制信号分子的运输、活化、代谢 ,以及各种酶作用底物的催化激活[17 ]. Zhao 等[18 ]筛选出特异性结合 Smad224 , Smad7 的 SARA (Smadanchor for receptor activation) 肽适体 ,用于抑制转化生长因子(TGF) 介导的信号转导和上皮细胞向间质细胞转化(epithelial2to2mesenchymal transitionby , EMT) 的生理过程.TGF 激活途径是与体内特异性配体结合后 ,激活受体激酶 ,引起 Smad2 和 Smad3 的磷酸化[18 ].研究发现 ,实验中肽适体只能与磷酸化的Smad224 特异性结合 ,与无活性 Smad224 结合很少 ,这可能是由于 Smad 经磷酸化后暴露出 Smad 锚定受体能与筛选出的 SARA 肽适体通过结合模序相互识别、结合 ,从而抑制二聚化 ,阻碍了 TGF 介导的基因表达. Smad7 是一种负性调节因子[19 ],SARA 肽适体与 Smad7 的结合与前介绍的有所不同 , 它不受Smad7 磷酸化水平的影响 ,因此 SARA 肽适体可以用于检测信号转导途径中 Smad 的活性水平.
肽适体与现有的分子生物学检测技术相比 ,优势在于可以直接鉴定真核细胞载体所表达的靶标蛋白 ,无需纯化 ,为“逻辑遗传学”(logic of genetics) 的研究发展奠定了坚实的基础. 肽适体是一种内源性的多肽片段 ,通过与特异性靶蛋白特异功能位点结合调控基因表达从而模拟“干扰基因”(perturbogens)的作用[20 ]. de Chassey 等[8 ] 筛选出了一种可以抑制肿瘤细胞增殖的 R5G42 肽适体 ,分析其机制可能是通过肽适体特异性识别转录因子的共调控蛋白 ,二者结合后形成一定的空间位阻 , 直接或间接的抑制基因表达 ,从而抑制了肿瘤细胞的增殖、分化. Abed等[21 ] 研制的肽适体 F4 ,针对其靶蛋白 Fur (ferricuptake regulator) 具有明显的抑制作用 ,并通过与基因敲除等技术比较 ,表明肽适体在多功能蛋白的选择性抑制方面具有特殊的作用. 肽适体不但具有抑制作用 ,对某些靶蛋白而言 ,肽适体还是一种有效的激活剂.
3. 2 肽适体的稳定性和穿透性
肽适体在体内可折叠形成稳定的三级构象 ,与一般游离的氨基酸相比降低了热力学的熵值 ,有利于保持较高的生物学活性. 随着基因组学和蛋白质组学领域的研究进展 ,人工表达蛋白的稳定性和产率都在不断提高. 现已有多种小片段 ,易表达的支架蛋白被广泛用于肽适体领域[22 ]. 它们各自的生物学特性有利于肽适体应用的进一步发展 ,如在表达过程中能通过空间折叠形成保护功能效应域 ,与效应分子结合后 ,通过变构效应暴露活性功能效应域 ,达到对肽适体的保护作用. 目前使用较广泛的是硫氧还蛋白 A(thioredoxinA ,TrxA) ,利用 TrxA 作为限制性肽适体的支架有利于提高肽适体与筛选靶物质结合的亲和力. 经研究证明 ,Colas 等[23 ] 筛选出的一种用于抑制依赖细胞周期性激酶 2 (cdk2) 的 TrxA2肽适体复合物 ,其半抑制浓度 ( IC50) 比普通游离状态下要低 50~1 000倍. 更重要的是 ,肽适体融合于 Trx 支架蛋白上有利于其在哺乳动物细胞中的表达. Cohen等[24 ]构建了利用骨肉瘤细胞 (Saos22) 表达的 TrxA2肽适体可以有效地抑细胞增殖和分化. 并以此为基础研发出可与 Mdm2 基因编码的锌指蛋白特异性结合的 TrxA2肽适体 ,用于活化 p53 敏感的报道基因具有良好的效果[25 ]. Cui 等[26 ]筛选出的以 TrxA 作为支架蛋白并在 xFoxH1b 和 Lef1 中较好表达的肽适体 ,可与 Smads 特异性结合并选择性的抑制 TGF 敏感的报告基因.
具有细胞穿透性的氨基酸肽段一般为兼性氨基酸 ,它们通过与转运载体共价连接介导其在胞内的转运. Matsushita 等[27 ]设计了一种新型调控分泌的生物开关. 先在多肽片段的 N2末端上连接 1 个保持细胞穿透性的序列 ,而在 C 末端固定一个抑制分泌功能的序列 ,通过激活不同序列的转录活性 ,活化或抑制分泌功能. 并以此为基础研制出了细胞穿透性肽适体(cell2penetrating aptamer peptides CPAPs) . 多种来源的 CPAPs 可与不同生物学活性的修饰基团共价连接 ,介导其在胞内转运并特异性识别靶物质 ,发挥作为靶向分子的生物学作用[28 ]. Green 等[29 ] 利用CPAPs 构建了研究蛋白转导功能域的生物学模型.Trehin 等[30 ]将 CPAPs 用于靶向定位药物在体内转运、代谢的研究获得了良好的成效.
4 肽适体的应用
肽适体通过与配基的特异性识别 ,为高置信限水平靶标确认提供了有利的工具. 分析肽适体与目的蛋白之间的精细调节可在候选蛋白群中筛选出意义蛋白 ,为新药研发中的药物靶向位点确定提供了
一个新的技术平台. 现已有一种肽适体印记技术(AptaPrintTM)[3 ]可用于快速靶向定位 (Fig. 4) . 首先通过分析靶蛋白的生物学活性 ,定位特征性功能域或是构建同源性模型 ,如 :酶的活性位点、介导蛋白相互作用的结合位点 ,或是形成特殊空间的“口袋”结构域 ;接着利用氨基酸置换介导这些功能特异性位点的定向突变 ,经酵母双杂交系统展示突变异种 ,并可通过自身的阳性选择鉴别有意义的结构功能域. 这种技术的突破在于 AptaPrintTM 可依靠目的位点或是邻近部位的高分辨率解决由于氨基酸置换介导的结构修饰 ,而产生诱导作用或是影响了蛋白质固有的折叠. 另一个突破就是利用软件可以精确地构建同源性物质的结构模型. 肽适体可以结合于不同物质的反应表面 ,特异性识别蛋白的不同功能域.虽然肽适体是小分子蛋白 ,但它不是一种平面结构 ,而是以一种多态性的空间结构存在的 (包括各种折叠、螺旋、口袋等) .

5 展望
与反义核酸技术相比 ,肽适体技术还显得相当年轻 ,但它们针对靶物质的多元生物学活性(既可以抑制 ,也可以激活) 已引起了学者的广泛关注. 利用肽适体对不同表型的筛选以及对不同表面分子不同功能结构域的鉴别 ,有利于拓宽对蛋白质组学的研究 ,加快新药研发的进程.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志