摘要
抗癌肽能够靶向作用于癌细胞,而不损伤正常组织细胞的主要原因在于癌细胞膜表面一些阴离子成分的特异性表达,包括磷脂酰丝氨酸、O-糖基化粘蛋白、唾液酸神经节苷脂和肝素等[11]。大量研究表明,抗癌肽的作用机制可以分为膜裂解机制和非膜裂解机制(图 1和图 2)。其中抗癌肽的膜裂解机制主要有以下3种,分别是“桶板模型”、“毡毯模型”和“环形孔模型”(图 1)[12-13]。
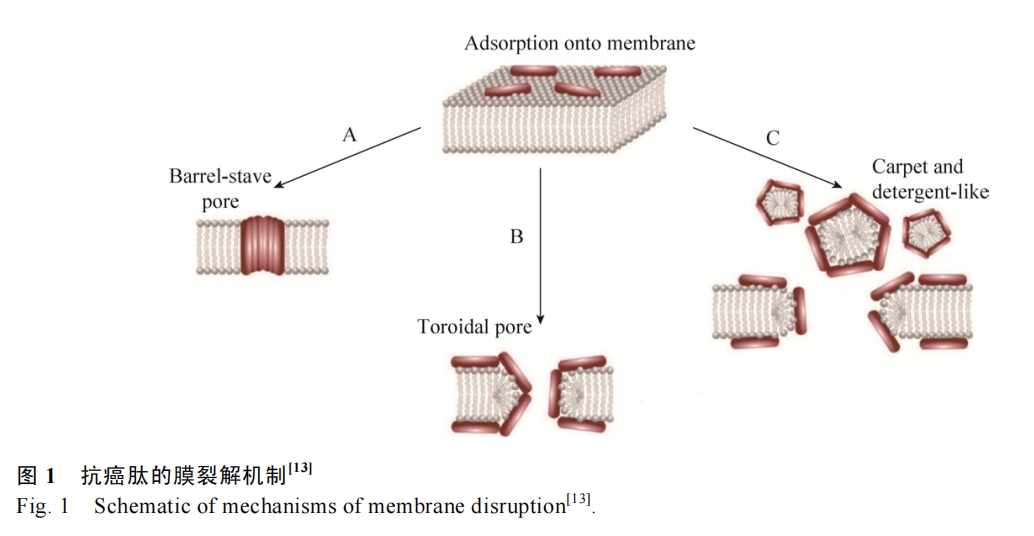
2.1.1 桶板模型
1977年Ehrenstein等首次提出了抗菌肽的桶板模型(图 1)[14]。抗癌肽在癌细胞膜表面通过疏水作用寡聚体化,其中抗癌肽的疏水面向外朝向细胞膜的酰基链,而亲水面形成孔或槽,最终在不断的聚集过程中形成穿透质膜离子孔道,进而导致癌细胞内容物流出,失去大量离子和能量,胞内渗透压改变,进而瓦解细胞膜。理论上这种孔道至少由3个抗癌肽分子组成,并且要求它们有一定的二级结构,比如两亲性的α-螺旋、β-折叠或同时含有α-螺旋和β-折叠[15]。很多抗癌肽均被证明是通过桶板模型来发挥其抗癌作用的。如在1994年,Sui等证明了分离自意蜂Apis mellifera的Melittin可以通过桶板模型破坏癌细胞膜的完整性[16]。Melittin又名蜂毒肽,是蜂毒的主要成分,由26个氨基酸残基组成,其功能多样,如有抗炎、镇痛、抗菌、抗HIV及抗肿瘤等多种药理活性[17]。蜂毒肽具有广谱的抗肿瘤活性,包括人肝细胞癌、白血病、乳腺癌等,桶板模型是其多种抗肿瘤机制之一[18-19]。来自咆哮草蛙Litoria raniformis的抗癌肽Aurein1.2对白血病、肺癌、结肠癌等均有杀伤作用,其主要机制也是通过桶板模型来破坏肿瘤细胞[20]。
2.1.2 毡毯模型
1992年Pouny等提出了抗菌肽的“毡毯”模型[21]。阳离子抗癌肽也可以通过静电作用结合到带负离子的癌细胞膜上,以类似毡毯的结构平行排列,当抗癌肽达到临界浓度时,细胞膜能量恶化,稳定性降低而出现显著的弯曲从而破裂(图 1)。区别于桶板模型,毡毯模型不需要抗癌肽具有特殊结构,并且不形成跨膜通道[15]。Cecropins类抗癌肽,又名天蚕素,是第一个被发现的动物抗菌肽,在昆虫和哺乳类动物中均有发现,其对白血病、膀胱癌等均有强杀伤作用,可通过毡毯模型发挥作用[22]。Chuang等报道了人体唯一一种Cathelicidin类抗菌肽LL-37,也可以通过毡毯模型选择性地裂解卵巢癌[23]。另外,Magainins (来自非洲爪蟾,Xenopus laevis)[24]、Citropin 1.1 (来自雨滨蛙,Litoria citropa)[25]、Gaegurins (来自皱皮蛙,Rana rugosa)[26]等多种抗癌肽,均可通过毡毯模型来发挥其抗癌作用。
2.1.3 环形孔模型
在环形孔模型中,抗癌肽的疏水区与癌细胞膜上的疏水区相互移动而导致胞膜破裂缺失,最终形成跨膜孔道(图 1)。其与桶板模型最主要的区别在于抗癌肽始终与磷脂的头部结合而一起构成跨膜通道。1997年,Matsuzaki等报道了Magainin-2可以“环形孔”模型发挥抗菌作用[27]。Magainins,又名爪蟾素,分离自非洲爪蟾的皮肤,是较早发现的两栖动物抗菌肽,其具有广谱的抗菌抗癌活性,其中可以通过环形孔模型破坏人的宫颈癌细胞HeLa的细胞膜[28]。
除了上述3种机制外,还有一种破膜机制叫做Shai-Huang-Matsuzaki (SHM)模型,被认为是毡毯模型和环形孔模型的结合[29]。这些模型虽然都是抗癌肽与癌细胞膜的相互作用导致细胞膜裂解,但是其内在的分子机制有所不同。但是,大量报道证明,许多抗癌肽可以通过不同的作用方式应对不同的癌细胞,以Magainin类抗癌肽为例,其抗癌作用方式既有环形孔又有毡毯模型,甚至还有非膜裂解机制[24, 28, 30]。
2.2 抗癌肽的非膜裂解机制
抗癌肽的作用机制除了改变癌细胞膜通透性以外,还可以与癌细胞的内源靶标相互作用,进而诱导癌细胞的死亡(图 2)。
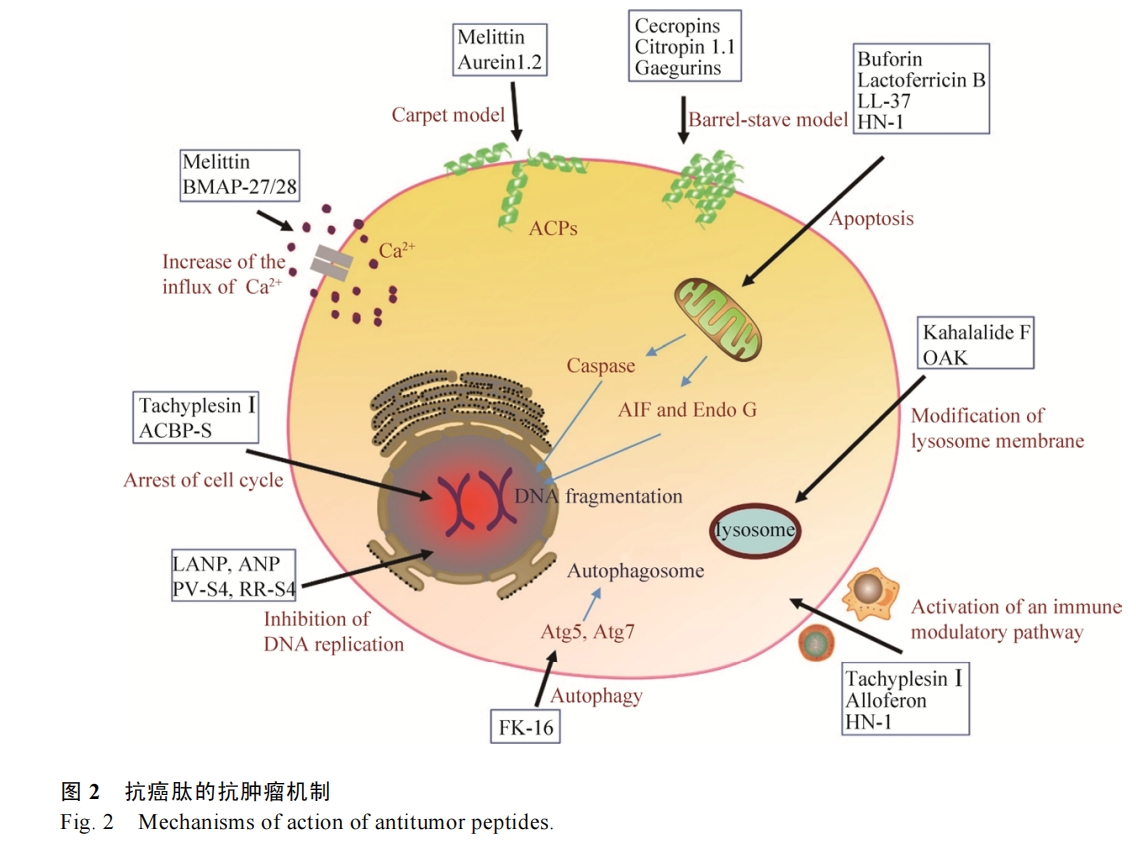
2.2.1 诱导凋亡途径
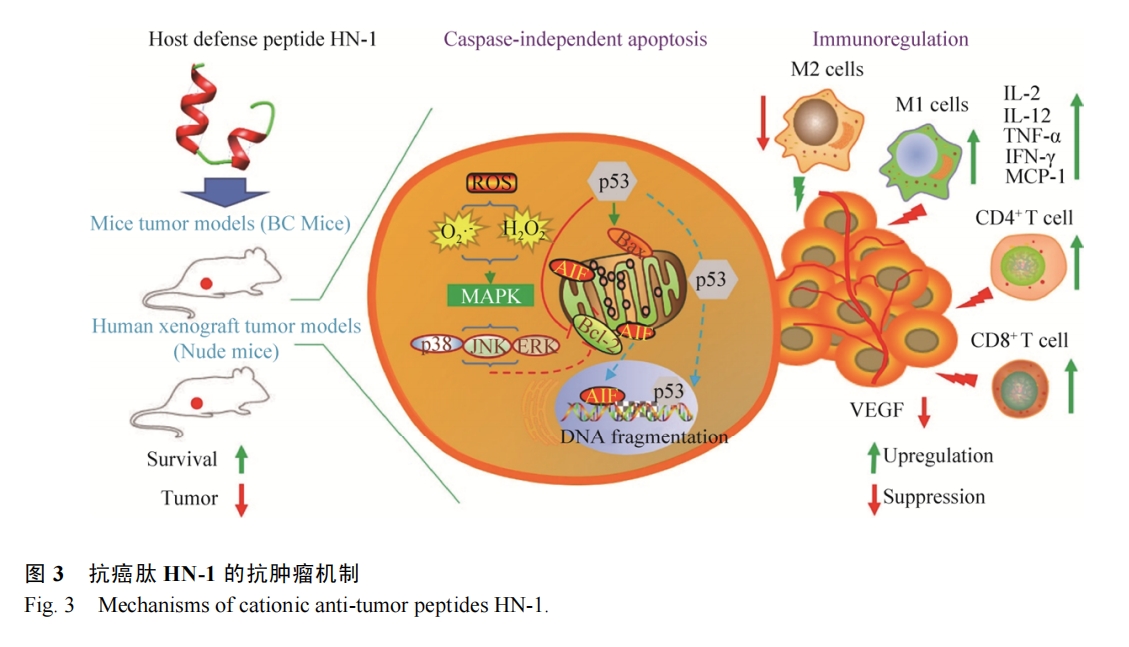
大量的研究证实抗癌肽可通过激活凋亡通路来执行功能,凋亡细胞表现出一系列形态和生化特征的变化,如胞质皱缩、磷脂酰丝氨酸外翻、染色质凝聚、DNA片段化、核膜核仁破碎等[31]。一般来说凋亡分为内源性凋亡即线粒体途径和外源性凋亡即死亡受体途径,其中半胱天冬酶(Caspase)-9和-8分别是二者标志性中间激活物,caspase-3,6,7是二者共同的凋亡执行者[32]。Lee等发现来自中华大蟾蜍Bufo bufo gargarizans的抗癌肽BuforinⅡb对多达62株癌细胞都有强杀伤作用,其可破坏线粒体膜,释放细胞色素C,进而激活caspase级联,诱导一系列蛋白水解反应导致细胞瓦解(内源性凋亡)[33]。Chen等将tachyplesinⅠ的C端连接一段带有RGD的短肽,发现获得的RGD-tachyplesinⅠ在体内外均可抑制肿瘤生长,并且激活caspase-3,6,7,8,9以及fas配体相关死亡域表达,也就是说其可同时激活线粒体途径和死亡受体途径[34]。不仅如此,近年来相继出现很多报道证明抗癌肽还能够激活不依赖于caspase的凋亡通路。这种凋亡通路不需要caspase的激活,而是促使存在于线粒体内外膜间隙的细胞凋亡诱导因子(AIF)和核酸内切酶G (EndoG)核转移,进而引起DNA裂解和染色质凝集等[35]。Ren等发现LL-37是通过激活caspase非依赖性的凋亡通路抑制人结肠癌细胞的生长。LL-37有效激活细胞中的抑癌基因p53的表达,进而诱导多种转录靶标的表达包括Bcl-2家族的促凋亡蛋白如BAX、Bak和Puma,这些因子能促进线粒体生理机能的改变,进而释放AIF和EndoG进入细胞核执行凋亡功能[36]。本实验室前期工作从海南湍蛙Amolops hainanensis中提取到了一种抗菌肽HN-1具有广谱的抗菌活性[37],后续实验发现其对癌细胞具有选择性杀伤作用,且有效激活了caspase非依赖性的凋亡通路抑制人乳腺癌细胞MCF-7的生长(图 3)。
2.2.2 阻止细胞周期于G0、G1或S期
细胞周期是细胞生命活动的基本过程,其依赖于各级调控因子的精确调控。大量报道指出抗癌肽可阻滞癌细胞于不同时期,从而抑制癌细胞的增殖。Li等[38]发现TachyplesinⅠ使人肝癌细胞SMMC-7721细胞阻滞在G0/G1期,实验中TachyplesinⅠ下调突变p53、细胞周期蛋白D1和CDK4的蛋白水平,降低c-Myc的mRNA水平,并且促进p16和p21WAF1/CIP1的表达,可见TachyplesinⅠ通过对这些细胞周期相关基因表达的调节,进而抑制SMMC-7721的增殖。Zhao等利用原核表达获得抗癌肽AGAP的重组体rAGAP,发现rAGAP能够抑制人胶质瘤细胞SHG-44的增殖和迁移,其机理是通过抑制G1细胞周期调控蛋白CDK2、CDK6和p-RB的表达,使SHG-44细胞周期被阻滞在G1阶段,进而显著抑制其增殖[39]。将胡桃肽WP1与纳米硒结合能够阻滞MCF-7细胞于S期,进而抑制其增殖[40]。
2.2.3 破坏溶酶体
癌细胞中溶酶体的通透性通常会发生改变,并且合成分泌大量的组织蛋白酶,它们与肿瘤的生长、侵袭和转移息息相关[41]。据报道一些抗癌肽可以破坏溶酶体膜,释放溶酶体内容物,导致细胞内环境酸化,直至癌细胞死亡[42]。如来自一种海参Elysia rufescens的抗癌肽Kahalalide F (KF),可以通过破坏癌细胞溶酶体结构来杀死癌细胞,其抑制的细胞株包括结肠癌、乳腺癌、非小细胞肺癌、前列腺癌、黑色素瘤等[43]。宿主防御肽模拟物OAK对小鼠前列腺腺癌细胞TRAMP-C2及其动物模型均有良好的抑制作用,并且可以克服多药耐药性。Held-Kuznetsov等发现,OAK的作用机制是通过破坏线粒体和溶酶体发挥作用[44]。
2.2.4 增加钙离子内流
癌细胞中Ca2+稳态会发生改变,这些改变与肿瘤的发生、增殖、代谢和血管的生成有关[45]。抗癌肽可改变细胞膜通透性而进入细胞,并且可增加细胞内Ca2+内流,随后通过静电吸附作用于线粒体,在Ca2+的协同下作用于线粒体通透性转换孔(PTP),导致内容物外流引起癌细胞死亡。蜂毒肽Melittin可以通过增强Ca2+的流入和桶板模型等机制来杀死人的肝癌细胞[46]。另外,Risso等也发现来自家牛Bos taurus的BMAP-27/28对白血病、淋巴癌等都有很好的抑制作用,其机制就是改变细胞膜的通透性和提高细胞中Ca2+内流,并伴随着DNA的片段化,进而诱导癌细胞的死亡[47]。
2.2.5 抑制DNA合成
诱导靶细胞DNA片段化是多种抗癌肽的作用效果,但不一定是抗癌肽直接作用于DNA,比如凋亡通路也会引起DNA断裂。近年来研究发现有些抗癌肽可以直接与癌细胞染色体DNA或相关酶相互作用,进而干扰或抑制癌细胞的DNA合成。Gower等[48]发现4种利尿钠肽(LANP、ANP、BNP和CNP)对人的结肠癌细胞有抑制作用,其抗肿瘤机制就是通过抑制环磷酸鸟苷(Cyclic GMP)介导的癌细胞DNA合成来阻止癌细胞增殖的。Hariton-Gazal等[49]通过实验发现经过加工改造后的抗癌肽PV-S4和RR-S4可以结合到Hela细胞核染色体上,使其DNA出现断裂,进而诱导肿瘤细胞死亡。另外,分离自Elysia rufescens的抗癌肽Kahalalide F (KF)、来自淀粉核小球藻的CPAP等均能通过阻止DNA复制来杀死肿瘤细胞[18]。
2.2.6 促使癌细胞自噬
细胞自噬也称Ⅱ型程序性细胞死亡,是细胞中高度保守的自行降解过程,自噬使饥饿或缺乏生长因子的细胞得以暂时成活,而那些持续不能获得营养的细胞将消化所有可获得的基质,最终导致自噬相关性细胞死亡。近年来发现其也是抗癌肽的肿瘤抑制机制之一[50-51]。Ren等[52]报道了LL-37的片段FK-16 (第17–32个氨基酸)可诱导结肠癌细胞HCT116凋亡和自噬,但是对正常结肠上皮细胞NCM460毒性很小。FK-16提高了结肠癌细胞中自噬相关蛋白LC3-Ⅰ/Ⅱ、Atg5和Atg7的表达量,同时在共聚焦和电子显微镜下观察到LC3阳性的自噬体的形成。当敲除掉Atg5和Atg7后,大大降低了FK-16对结肠癌细胞的杀伤作用,说明诱导癌细胞自噬是FK-16发挥作用的重要机制。
2.2.7 激活肿瘤免疫
免疫系统在机体控制和清除肿瘤方面起到了至关重要的作用,但仍难以阻止肿瘤的发生和发展。这与复杂的肿瘤微环境密不可分,一方面,肿瘤细胞可分泌促进肿瘤生长、转移的细胞因子,如转化生长因子-β、血管内皮生长等[53];另一方面,恶性肿瘤可以通过多重机制免疫应答,从而逃逸免疫系统的攻击作用,如使肿瘤浸润的CD8+ CTLs和CD4+ Th1细胞处于一种功能耗竭或无能状态,无法对肿瘤进行免疫监视和清除[54]。因此诱导免疫活化、打破免疫耐受等已成为热门的免疫治疗方向,如免疫检查点抑制剂[55]。有研究证明有些抗癌肽可以调节机体的免疫应答发挥其抗肿瘤作用。Chen等[56]报道TachyplesinⅠ能够促使细胞表面的透明质烷和血清中补体途径的关键成分C1q补体相互作用,并且激活其下游的C3和C4的裂解和沉积,以及C5b-9的形成,激活典型补体途径从而破坏癌细胞的完整性。Chernysh等报道了来自红头丽蝇Calliphora vicina的抗菌肽alloferon可通过激活免疫应答抑制肿瘤生长。通过体外将小鼠淋巴细胞或人的血液单核细胞进行试验,发现alloferon可激活自然杀伤(NK)细胞和干扰素(IFN)的表达[57]。Huang等[58]发现从比目鱼豹鳎Pardachirus marmoratus分离的抗癌肽GE33可以作为疫苗佐剂提升灭活膀胱癌细胞(MBT-2)的免疫原性,在小鼠体内显著提高了CTL细胞和NK细胞数量以及特异性抗体水平等,证明了抗癌肽的免疫调节潜能。本课题组发现的抗癌肽HN-1在动物体内激活了CD4+ T细胞和巨噬细胞在肿瘤中的浸润,并且提高了肿瘤相关细胞因子在血清中的水平(图 3)。
2.2.8 抑制肿瘤血管新生
新生血管形成与肿瘤侵袭和转移息息相关,其为肿瘤组织提供氧气和营养,促进肿瘤细胞迅速增殖,同时为肿瘤的远端转移提供转运[59]。因此靶向肿瘤新生血管生成或相关因子的抗癌类药物研发具有重大意义。Mader等[60]通过实验发现Lactoferricin B在体外通过阻止细胞生长因子(bFGF)和血管内皮生长因子(VEGF165)与受体结合而抑制人脐静脉内皮细胞(HUVECs)增殖,并且在C57BL/6小鼠体内抑制二者诱导的血管生成。Hou等[61]将人工设计抗菌肽与靶向给药序列isoDGR相连接,发现其能够与αvβ3+ (肿瘤细胞过表达)结合从而抑制血管的生成,充分证明了抗癌肽具有抑制血管新生的潜能。
3 总结与展望
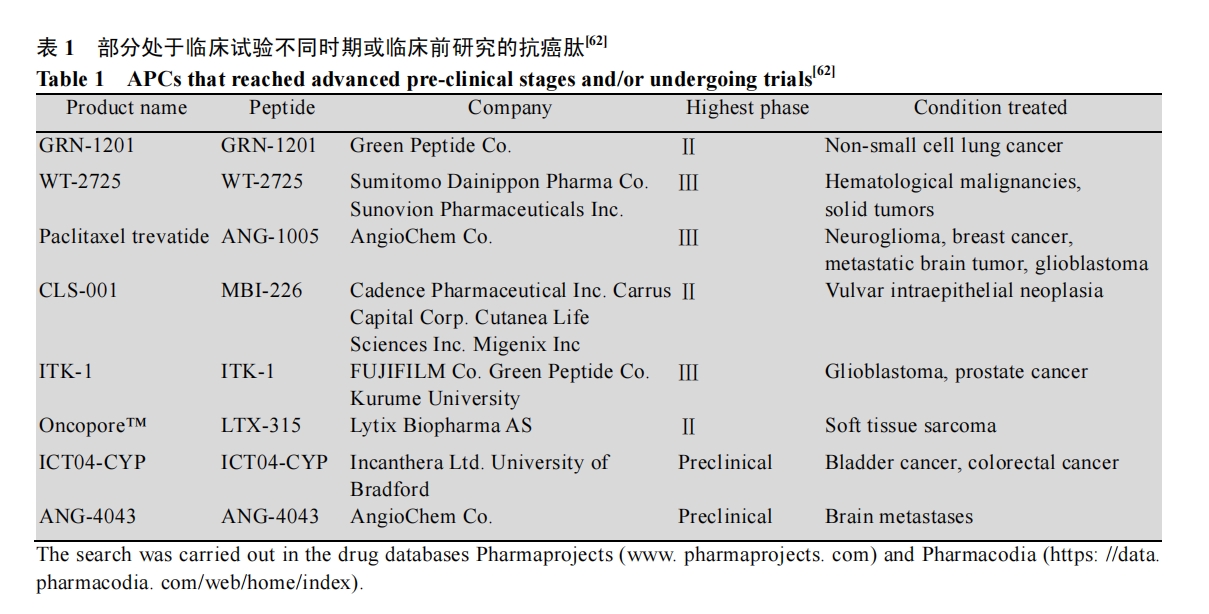
在过去的20年中,天然活性分子的多种治疗潜能的持续发现引发了科学界的广泛注意。抗癌肽由于其特殊的阳离子和两亲性的结构特征以及其众多的抗癌机制,使其发挥了良好的抗癌作用或者增强化疗药物的效果,因而有望用于提高化疗药物的敏感性,同时减少对正常组织的毒副作用。目前已有大量不同治疗目的肽类药物进入临床或批准上市,如表 1所示,当前已有部分处于临床试验阶段的抗癌肽,并取得了一定的效果[62]。但是抗癌肽的应用和研发仍面临一些挑战,如合成成本较高、易被蛋白酶水解、易聚合、半衰期较短等[63]。因而当前抗癌肽的设计也集中于截短序列等,以降低成本[64];解决蛋白酶的水解问题,可以通过将天然氨基酸替换成非天然氨基酸,比如设计D-对映体肽、β2,2氨基酸替换、肽骨干环化、end-capping如c-酰胺化、糖类coating等[65-67];提高半衰期可以将抗癌肽聚乙二醇修饰(PEGylation),结合到血清白蛋白或抗体片段等[68]。由此可见虽然抗癌肽在肿瘤治疗方面有很好临床应用价值,但是仍需克服这些缺陷和挑战,才能在肿瘤药物治疗领域有一席之地。因此,进一步确定和发现更多抗癌肽模板和抗肿瘤机制以及克服肽类药物缺点的新方法对抗肿瘤临床治疗药剂的发展具有重大意义。
免责声明:本文为行业交流学习,文章标注了原作者及出处,版权归原作者所有,如有侵权,可联系删除。