
[摘 要] 抗菌药物滥用导致细菌耐药形势不断加剧,细菌耐药性已成为日益严重的公共卫生问题。本文介绍不同抗菌药物如何发挥抗菌作用,以及细菌通过改变细胞膜通透性等方式产生耐药性的机制。为解决细菌耐药性问题,学者们提出了抗菌药物联合应用的协同抗菌策略,以期通过多靶点、多途径的作用方式,降低细菌产生耐药的概率,同时提高抗菌效力。本文从协同抗菌机制出发,对不同抗菌药物联合应用的协同抗菌作用进行综述,并重点介绍抗菌肽与传统抗菌药物联合应用的协同效果,以及在不同领域应用的研究进展,旨在进一步推动抗菌肽等新型抗菌药物应用策略创新,抑制细菌耐药性的发展。
抗菌药物是一类能够抑制细菌、真菌等病原微生物生长繁殖或直接杀灭病原微生物的化学物质,如抗生素、抗菌肽等。自1928年英国科学家弗莱明发现第一个抗生素—青霉素以来,抗生素被广泛应用于疾病的防治中,挽救了无数的生命。起初,抗生素是一种被用作治疗细菌感染的药物,然而近年来抗菌药物的超标使用、无节制滥用,导致细菌耐药性问题日益严重。技术迭代缓慢致使新药研发困难,细菌产生耐药的速度远超过新抗菌药物研发速度,抗菌药 物 尤 其 是 抗 生 素 领 域 的 专 利 申 请 数 量 在2011年后呈现下降的趋势,世界范围内即将面临重症细菌感染无药可用的境地。因此,合理使用现有抗菌药物,提升抗菌药物的利用效率,抑制细菌耐药性的发展迫在眉睫。本文就不同抗菌药物的抗菌机制,以及细菌产生耐药性的特点,重点介绍极具抗生素替代潜质的AMPs与传统抗菌药物联合抗菌的策略。该策略作为一种新的治疗耐药细菌感染和减少细菌耐药性产生的有效方法,发挥协同增效的抗菌作用,降低单个抗菌药物的用量,创新AMPs应用策略,为解决传统抗菌药物耐药性问题提供新方向。
1 抗菌药物的抗菌机制
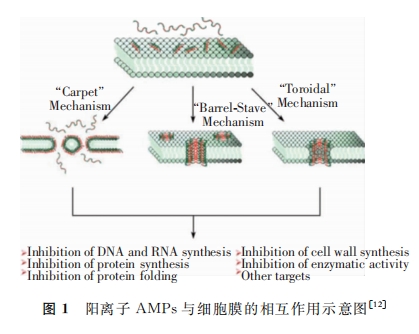
抗菌药物的抗菌机制主要有以下4种:抑制细菌细胞壁的形成,破坏细胞 膜结构,干扰细菌内DNA 的复制、转录及翻译,破坏蛋白质合成。值得注意的是,抗菌药物不仅可以通过其中某一种机制发挥抗菌作用,也可以通过多种机制相结合的方式发挥抗菌效力。
在DNA复 制 过 程 中,DNA拓 扑 异 构 酶 催 化DNA链的断裂与结合,影响DNA链的拓扑状态。旋转酶和拓扑异构酶IV作为DNA复制过程中最重要的两个拓扑异构酶,是抗菌药物常见靶点。目前DNA聚合酶也是研究较为广泛的药物潜在靶点。此外,抗菌药物可以通过与RNA 聚合酶结合,干扰细菌DNA转 录 及 RNA 延 伸,起到杀菌作用。部分抗菌药物还能够通过干扰蛋白质合成起始阶段、肽链的 延伸、氨基酸代谢等发挥抗 菌功能。某些富含脯氨酸的 AMPs可以被细菌的特殊转运载体经主 动 运输到细 胞内特定靶点,与70S核糖体相互作用进而破坏蛋白质合成,达到杀灭细菌的目的。
2 细菌耐药性的产生
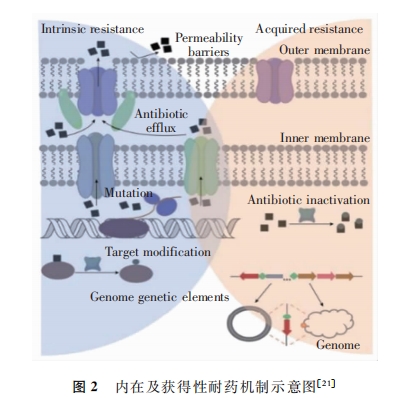
耐药的发生是细菌在持续抗菌药物作用下,感受自身所处的不良环境条件而产生的防御机制。细菌通过细胞膜通透性改变,主动外排泵系统过表达,作用靶点结构改变,抗菌药物的破坏与修饰,以及携带外源性耐药基因等方式对抗菌药物产生耐药性,如图2所示
细胞膜的通透性以及抗菌药物进入细胞的能力是决定药物疗效的关键性因素,一些细菌细胞膜通道或细胞壁孔道的改变,使得抗菌药物不易进入菌体,进而产生耐药性。药物外排泵在细菌中普遍存在,不仅能减少抗菌药物在细菌细胞内的积累,还为细菌提供了足够的时间适应不同药物,进入菌体的药物在外排泵作用下迅速排出,菌体细胞内药物浓度降低,耐药性随之产生。药物靶点结构的改变则会降低药物与靶点的亲和力,进而导致抗菌药物活性减弱或失活,是细菌产生耐药性的另一重要机制。此外,抗菌药物在发挥作用的过程中其本身也可能被降解或发生结构改变,该过程往往有酶的参与。一方面,蛋白酶的水解作用导致对酶敏感的抗菌药物的关键反应中心被破坏或发生不易逆转的结构重排;另一方面,抗菌药物的共价修饰阻碍药物与其靶点的相互作用,从而导致耐药的产生。
如果仅依靠上述耐药机制,细菌的多重耐药不易在短时间内暴发。此外,细菌还通过偶联、转化或转导获得携带耐药基因的 DNA 元 件,以 水 平 基 因 转 移 的方式从其他细菌中获得外源性耐药基因,整合入自身基因组而产生MDR。
3 联合用药协同抗菌
由于细菌耐药性的持续发展,致使很多严重的临床细菌感染使用现有抗菌药物很难达到理想的治疗效果,而新药研发缓慢,成本较高,推广困难,且同样存在引发耐药性的风险。因此,基于不同抗菌药物对细菌抗菌机制不同而进行联合用药,有望成为对抗细菌耐药性的新策略。此策略能够将现有抗菌药物进行再利用,使抗菌效果最大化,避免新药研发的巨额费用。与单一抗菌药物相比,抗菌药物联用具有多靶点的抗菌作用方式,能够有效杀灭耐药菌株,并抑制细菌耐药性的发展。
除单一细菌自身能够对抗菌药物产生耐药性外,细菌黏附于物体表面,通过分泌多糖等物质使彼此聚集在一起并进一步增殖,最终形成致密的具有屏障作用的生物膜,抵抗抗菌药物的作用,使得细菌的耐药性大幅度提高。因此,有学者将对细菌生膜具有高度破坏作用的抗菌药物与其他不具有生物膜破坏作用或破坏作用较小的抗菌药物联用,以期能够发挥协同抗菌活性。已有研究发现,AMPs能够破坏细菌生物膜,当 AMPs与抗菌药物联合使用时,AMPs的抗生物膜特性能够提高抗菌药物的抗菌效果。
3.2 传统抗菌药物的联合应用 传统方法的单一抗菌药物治疗细菌感染很容易引起耐药,而抗菌药物联合应用,即同时使用两种或两种以上的抗菌药物,通过作用于多个靶点,从而提高抗菌效果,延缓耐药性的发展,是目前对现有传统抗菌药物再利用的有效方式。
抗菌药物的协同抗菌活性可通过棋盘法测定联合用药时抗菌药物的最低抑菌浓度计算部分抑菌浓度指 数来评价,当FIC index≤0.5时,判定为协同作用;当0.5<FIC index<4时,判定为无相互作用;当FIC index≥4时,判定为拮抗作用。笔者前期研究发现,将妥布霉素与特殊官能团连接,设计获得的两亲性妥布霉素衍生物可以显著提高利福平或二甲胺四环素对多重耐药铜绿假单胞菌的抗菌活性,表现出极强的协同抗菌作用,其FIC index达到0.039。两者的协同机制研 究发 现,两 亲性妥布霉素衍生物能够影响细胞膜上呼吸链的电子传递进而降低 ATP 的生成,抑制细胞膜上抗菌药物外排泵的功能,进而发挥协同抗菌作用。细菌细胞膜上抗菌药物外排泵的过表达是很多细菌产生耐药性的主要机制之一,目前研究的抗菌药物外排泵抑制剂如1-(1-萘甲基)哌嗪等能够恢复某些革兰阴性菌对抗菌药物的敏感性,但对于通过细胞壁屏障作用产生内源耐药性的细菌有效性大大降低。因此,增强细胞膜通透性同时降低抗菌药物外排泵功能是解决此问题的理想策略。本课题组将妥布霉素作为载体,与1-(1-萘甲基)哌嗪等不同外排泵抑制剂相连,获得了一系列化合物,该化合物与传统抗菌药物联合应用,显著提高了氟喹诺酮类抗菌药物环丙沙星、莫西沙星对耐药性铜绿假单胞菌的抗菌活性.
金黄色葡萄球菌是一种革兰阳性球形细菌,能够引起局部感染甚至危及生命,万古霉素和环丙沙星等常被用于治疗金黄色葡萄球菌感染。为避免单独使用这些抗菌药物在治疗过程中可能引发的耐药性问题,Kamble等提出联合使用不同抗菌药物,将达托霉素和万古霉素这类针对细胞结构的抗生素与另一种作用于 DNA 复制或蛋白质合成过程的抗菌药物如环丙沙星或妥布霉素两两组合;所有组合均显示出协同效应,并以剂量依赖的方式抑制和破坏生物膜。由此可见,这些传统抗菌药物联合使用比单独使用两者中任何一种药物更为有效,并有望缓解细菌耐药问题。
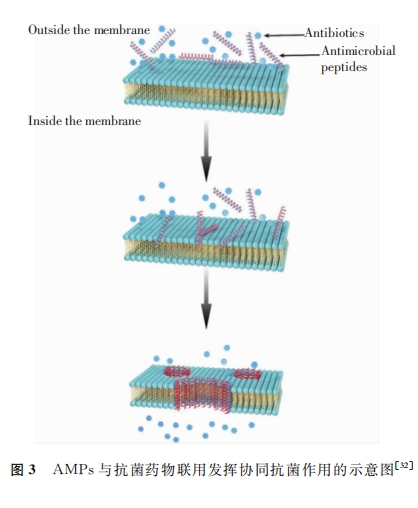
3.3 AMPs与传统抗菌药物联合应用 MDR菌的出现以及随后使用传统抗菌药物治疗的失败,助推了新型抗菌药物的研发。AMPs作为生物体天然免疫系统的组成部分,鉴于其广谱的抗菌活性、无残留、无污染等特点,被认为具有开发为新型抗菌药物替代抗生素的潜质。更重要的是,普遍认为AMPs通过破坏细菌的细胞膜结构完整性发挥抗菌作用,此种抑菌方式不易引发耐药性,同时也为联合用药研究提供了理论基础。目前,关于AMPs与传统抗菌药物联合使用的研究已有诸多报道,且普遍认为二者的协同抗菌机制是AMPs对细菌细胞膜的破坏作用,致使细胞内抗菌药物浓度升高。本课题前期研究发现,具有细菌细胞膜破坏活性的AMPs与多种抗菌药物联用能够提高抗菌活性,且对临床分离的耐药菌株也具有较好的抗菌活性。如富含脯氨酸的脂肽 C12-PRP在与二甲胺四环素或利福平联合应用时,可显著提高二者对 MDR和广谱耐药铜绿假单胞菌的抗菌活性,脂肽C12-PRP具有进一步开发为抗菌药物佐剂的潜质。此外,有研究发现,AMPs与同样作用于细菌细胞膜的抗菌药物联合应用时也可以产生协同抗菌效果。Fi等研究发现,AMPsNisin与抗生素多黏菌素 E 联合应用时,AMPsNisin大幅降低多黏菌素 E 抑制细菌生物膜所需的药物浓度,提高抗生素的抗菌效率和细菌对抗生素的敏感性。Ja等研究表明,AMPsNisin和多黏菌素 E联合应用对广谱耐药型鲍曼不动杆菌和多黏菌素 E 耐药性铜绿假单胞菌均表现出协同抗菌活性。
部分AMPs存在一定细胞毒性且易被蛋白酶水解,也是制约其在临床中应用的又一重要原因。目前,为了最大限度地提高AMPs对不同细胞的选择性,一些研究试图通过序列修饰、肽链杂合和氨基酸替代等方法对AMPs进行修饰或改造。AamAP1-Lysine是以蝎毒中发现的AMPsAamAP1作为基础设计获得的一种合成肽衍生物,其与左氧氟沙星、氯霉素、利福平、红霉素联合应用时,对金黄色葡萄球菌和铜绿假单胞菌表现出不同程度的协同抗菌作用,且在一些组合中AamAP1-Lysine的最小抑菌浓度甚至从3μmol/L降低至0.01μmol/L。Almaaytah等[51]对 AamAP1-Lysine与利福平联用的抗生物膜活性研究中,测得FICindex低至0.058,表现出强协同作用。Duan 等研 究 也 发 现,来 源 于 斑 马 鱼 的AMPs衍生肽 Pt5-1c与抗生素联用后促进抗生素进入细菌细胞,从而对 MDR 菌产生协同抗菌效应以及抗生物膜效应。
3.4 AMPs与其他化合物的协同抗菌作用 除传统抗菌药物外,某些 AMPs与其他化合物也可产生协同抗菌作用。如蜂源 AMPsMelittin是一种研究比较透彻的水溶性好、系统毒性高的AMPs。Melittin能够破坏细菌细胞膜,具有强抗菌活性[53]。孙楠等[54]研究发现,Melittin与柠檬酸联合应用时对大肠埃希菌、肠炎沙门菌及金黄色葡萄球菌均显示出协同抗菌效应,当与乙酸联合应用时对肠炎沙门菌表现为协同抗菌作用。微生物源AMPs是由微生物分泌的用来保护自身并杀灭或抑制其他微生物的小分子多肽,通常具有广谱抗菌活性,如利用侧孢短芽孢杆菌产生的AMPsBrevilaterin。宁亚维等研究证实,AMPs与柠檬酸两者协同抑制大肠埃希菌的生长,破坏细菌细胞膜的完整性,导致细胞变形、DNA 降解及细胞内容物泄漏。柠檬酸能够有效抑制有机酸的降解,延缓食物腐败,同时AMPs与柠檬酸联合应用降低了单个抗菌药物的使用量,有望在食品保鲜中推广应用。
4 AMPs与传统抗菌药物联合应用进展
4.1 食品防腐 AMPs用作防腐剂,具有热稳定性好、安全无毒、抗菌性强等优点,因此在食品的防腐和保鲜中具有广阔的应用前景。 AMPsNisin在人体内不会长期积累,毒性小,作为食品防腐剂具有很高的安全性,且在某些地区已经被批准在食品贮藏中使用。Mirhoseini等研究发现,Nisin与氧化镁纳米颗粒具有协同抗菌效应,应用于牛奶的杀菌灭活中,能够降低牛奶中大肠埃希菌和金黄色葡萄球菌的菌群数量。Nisin与香芹酚的联用同样能抑制牛奶中细菌繁殖,有望成为奶制品的保鲜策略。此外,Li等[61]将β-环糊精与Nisin联合应用,有效提高了Nisin在胰蛋白酶中的稳定性,延缓Nisin的降解,显著抑制低熟猪肉中细菌的生长繁殖,使猪肉保持原有营养价值和独特的风味。
4.2 医药卫生 目前,由MDR菌引起的医院获得性感染严重危害公共卫生安全,迫切需要研发新的抗菌策略攻克细菌耐药性。AMPs具有多种生物学功能,在先天免疫系统中发挥重要作用。在AMPs临床应用策略创新研究中,Salouti等发现,当AMPsMBP-1与银纳米粒子联合使用时,显著降低金黄色葡萄球菌的定植率,提高伤口愈合率。抗菌药物联合应用在体内的协同抗菌活性也得到证实。张馨元等研究发现,AMPs LL-37和酰胺酶联合使用抑制感染粪肠球菌小鼠体内脏器中细菌的增殖,减轻脏器病理损伤。探索其协同机制发现,酰胺酶先破坏细菌细胞壁,有利于AMPs LL-37接触到细菌细胞膜,LL-37不仅能破坏细胞膜结构引菌体细胞内容物外泄,还能够与细胞内的蛋白质、核酸相结合,影响细胞的生命活动,两机制相辅相成有效提高对粪肠球菌的杀伤效率。与此同时,该方法降低酰胺酶的使用量,抑制细菌耐药性的产生。最近研究发现。LL-37与万古霉素、阿奇霉素、多黏菌素等抗生素联合使用有望成为治疗铜绿假单胞菌感染的新策略。此外,AMPs LP-23、DP-23和SPO与庆大霉素联用对临床分离的耐庆大霉素的大肠埃希菌表现出协同抗菌作用,进一步证实了AMPs与抗菌药物联用在治疗耐药菌株引起的细菌感染方面具有很大潜力。
4.3 动物养殖 在动物养殖中,AMPs可用于改善动物健康状况,促进动物生长,提高生长性能。王莉等研究证实,天蚕素和β-甘露聚糖酶对鹌鹑的生长有协同促进作用,一种合理的解释是β-甘露聚糖酶可降解甘露聚糖成为甘露寡糖,而甘露寡糖和AMPs均可刺激机体免疫系统细胞,减少肠道有害菌,提高日增重,降低料肉比。在肉鸡日粮中联合添加天蚕素和合生素改善了肉鸡小肠黏膜结构,促进小肠黏膜免疫细胞增殖。另一个被广泛研究的猪源AMPs PR-39与阿莫西林、土霉素、硫酸链霉素联合应用,针对畜禽常见病原菌表现出明显协同抗菌作用。
5 小结与展望