摘要:中枢神经系统(centralnervous system,CNS)疾病严重危害人类的生命健康,但由于血脑屏障(blood–brainbarrier,BBB)的存在,缺乏将药物输送到大脑的有效技术,严重影响其相关药物的开发成功率,致使这类疾病的治疗效果往往不尽如人意。因此,迫切需要一种新技术解决上述问题。脑靶向肽偶联药物由脑靶向肽、连接基团和有效载荷这三部分组成,其利用生物相关的内源性转运机制使生物活性分子透过BBB,并到达脑实质,已成为一种有前景的CNS药物输送系统。本文简要介绍了脑靶向肽、连接基团、有效载荷的种类及特征等,并列举了一些常见的脑靶向肽偶联药物,以及此类药物面临的挑战和改进的方法,以期为后续CNS药物的设计和开发提供新思路。
中枢神经系统(central nervous system,CNS)疾病是世界范围内的主要健康问题之一,尤其是脑卒中、脑癌、神经退行性疾病等。目前,这些疾病还没有行之有效的治疗方法,究其主要原因之一是大多数药物无法充分穿过血脑屏障(blood-brain barrier,BBB)。因此,克服此生物障碍仍然是开发CNS药物的主要挑战。BBB的基本组成部分是神经血管单元(neurovascular unit,NVU),主要由脑毛细血管内皮细胞和脑星形胶质细胞构成。此外,其他细胞也有助于BBB的形成和维持,包括神经元、少突细胞、小胶质细胞和肥大细胞等。然而,与存在于CNS外的大多数器官中的高渗透性脉管系统不同,BBB表现出高的跨内皮电阻(transendothelial electrical resistance,TEER)以及低的转胞率和细胞旁渗透性。研究表明,这都是由于紧密连接(tight junction,TJ)蛋白复合物构成的膜内颗粒形成的链网络相对有效地堵塞了脑微血管内皮细胞(cerebral microvascular endothelial cell,BMEC)之间的细胞旁通路。该结构虽然阻止了有毒物质或病原体进入CNS,但也显著限制了治疗和诊断药物进入大脑的可能性。此外,BBB内皮细胞中存在的ATP结合盒转运体(ABC转运体)将一些可能穿过BBB的化合物外排回血液,进一步限制了CNS中药物和成像探针的可用性。因此,只有极少数的分子被有效地输送到大脑。
为了克服限制药物输送到大脑的生物屏障,研究者已经尝试开发了多种策略。其中,一种具有前景的给药策略引起了研究者们的广泛关注。该策略属于一种非侵入给药方式,以脑靶向肽作为载体,将药物以化学键的方式与脑靶向肽偶联,脑靶向肽可以穿过BBB,将药物带入脑实质,从而达到治疗的目的。其结构与作用机制均与抗体偶联药物(antibody drug conjugates,ADC)相似,具体结构见图1A。
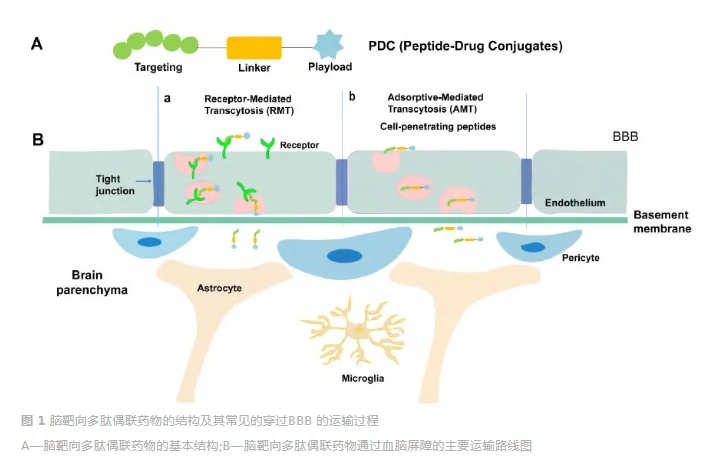

1 脑靶向肽偶联药物的结构
通常选择的脑靶向肽为靶向大脑内特定受体的多肽。这类多肽可以通过受体介导的胞吞作用(receptor-mediated transcytosis,RMT)特异性摄取某些大分子,其具体过程如图1B所示。常见的靶向大脑内特定受体的多肽见表2。

据研究,一种针对乳腺癌患者癌细胞脑转移情况的脑靶向肽偶药物ANG4043已经被合成,即Angiopep-2多肽偶联曲妥珠单抗。曲妥珠单抗可以靶向人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)的胞外结构域,使HER2阳性乳腺癌患者的生存率显著提高。但当癌细胞转移到大脑内时,由于其脑渗透能力差,它就缺乏疗效。因此,研究者选择靶向低密度脂蛋白受体相关蛋白1(low-density lipoprotein receptor-related proteins1,LRP1)的多肽Angiopep-2,与曲妥珠单抗偶联。LRP1是低密度脂蛋白(Low Density Lipoprotein,LDL)受体家族的一员,在BBB毛细血管内皮细胞上高度表达,并已被证明在脑毛细血管内皮细胞中转运多种配体,包括乳铁蛋白(lactoferrin,LF)、载脂蛋白E(apolipoprotein E,ApoE)和β-淀粉样肽等。该多肽偶联药物既保留了对HER2受体的体外结合亲和力和对HER2阳性BT-474乳腺导管癌细胞的抗增殖效力,又增加了脑内皮细胞的吸收。此外,测量颈动脉内递送后的脑暴露水平,发现该多肽偶联物以1.6×10-3mL/(g·s)的脑进入率穿透血脑屏障。最后,在脑内异种移植BT-474细胞的小鼠模型中,表明给予ANG4043治疗后可明显提高生存率。所以,这项研究表明Angiopepe-2与抗HER2单抗的结合可以增加脑内皮细胞的吸收以及BBB的通透性。ANG4043的这些特征导致BT-474脑肿瘤暴露水平较高,可以在全身治疗后延长生存期。既往研究表明狂犬病病毒糖肽(RVG)是由狂犬病病毒G蛋白中的29个氨基酸组成的多肽片段。RVG肽作为特异性配体,可识别γ-基丁酸(γ-aminobutyric acid,GABA)和烟碱乙酰胆碱受体(nAchR,Nicotinic acetylcholine receptor),促进病毒转运至CNS。因此,RVG肽常常用于修饰药物递送系统,以提高药物脑内递送效率。THR是通过噬菌体展示技术筛选出的12聚体多肽,可通过与转铁蛋白受体(TfR)结合,透过BBB,运输金纳米粒到达CNS。这些数据进一步验证了脑靶向多肽药物偶联策略可以作为神经肿瘤学和其他中枢神经神经系统疾病的治疗新方法。
某些细胞穿透肽(cell-penetrating peptides,CPPs)也常作为CNS药物的递送载体。CPPs指一般不超过30个氨基酸的多肽。通常表现出有助于跨细胞膜转运的两亲性和净正电荷特征。它们仅通过与暴露的细胞膜相互作用,便可独立地进入细胞,其机制可能为吸附介导的胞吞作用(Adsorptive-mediated transcytosis,AMT),具体过程如图1B所示。这是一种非特异性胞吞作用,由某些大分子的带正电部分与含有阴离子肝素蛋白多糖的脑内皮细胞带负电的膜之间的静电相互作用触发。此外,它们由于具有高细胞渗透性和低免疫原性的特点,也表现出不依赖于受体的特征。这也是它们被认为是安全的和高效的原因。但此类多肽往往缺乏一定的选择性。常见的相关细胞穿透肽见表3。

如TAT多肽是来自人类疫缺陷病毒1型(human immunodeficiency virus,HIV-1)的转录激活物TAT蛋白的转导结构域。它可以偶联异源蛋白质或纳米粒等,使其透过BBB。另外,它还可以运送量子点穿过BBB到达脑实质。Liu等在载环丙沙星的纳米胶束表面偶联TAT多肽,结果显示偶联TAT多肽,可以使该胶束穿过BBB,从而增强了人星形胶质细胞对胶束的摄取。SynB1作为一种来自于抗菌肽蛋白1的载体材料,在递送药物透过BBB方面已显示出一定优势。有实验表明SynB1在不影响BBB完整性的情况下,可以显著增强大脑中的吗啡-6-葡糖醛酸酯(M6G,Morphin-6-Glucuronid)的含量。
1.2 连接基团
完美的多肽偶联药物只有在到达指定部位后才会释放药物,而连接基团在这方面显得尤为重要。即一旦多肽偶联药物到达目标后,连接基团被裂解,药物以完全活性状态释放。所以,连接基团在循环时必须稳定,优先在目标部位裂解,从而确保最大剂量药物到达目标。然而,大多数连接基团在全身给药后,从进入血液那一刻开始就被裂解,当到达指定部位后,所剩不多的药物才被细胞吸收。因此,设计多肽偶联药物选择连接基团时,为避免干扰多肽与其受体的结合亲和力及药效,需要考虑到其所在的微环境,如其长度、稳定性、释放机制、官能团、亲水性/疏水性和其他特性。目前,多肽偶联药物的连接基团分为可裂解基团和不可裂解基团(丁二酰硫醚、肟和三唑等)两大类。可裂解基团又分为pH敏感型(缩醛,酮和碳酸酯)、酶敏感型(酯酶和酰胺酶、氨基甲酸酯)、氧化还原敏感型(二硫键)三大类。
在多肽偶联药物全身给药后,最不稳定的位点首先被裂解,其次是其他位点,最终成为包括未改性药物、具有部分连接基团的药物或带有连接基团的氨基酸在内的混合物。虽然在靶向治疗药物的开发中,可裂解的连接基团比不可裂解的连接基团更受青睐。但不可裂解基团具有不会因外部刺激而被裂解(如化学诱导的刺激)的优点,因而在循环中具有更高的稳定性,故其可能不会像可裂解基团那样在血液中就被裂解,并在到达目标部位之前在血液中过早释放一些药物。因此,脑靶向多肽和药物的具体连接方式,应根据实际需求确定。脑胶质瘤是最常见和最致命的原发性恶性脑肿瘤。由于存在药物溶解性差、缺乏肿瘤选择性、穿过BBB的渗透性差、以及广泛的肿瘤内和肿瘤间异质性等棘手问题,大多数治疗在临床上往往以失败告终。但一种只在CNS中表达的细胞外基质(extracellular matrix,ECM)糖蛋白,称为brevican(Bcan),被发现在脑胶质瘤中表现为上调,并与肿瘤侵袭性和侵袭性增加有关。其被称为dg-Bcan的去糖基化亚型仅在人类高级别胶质瘤(包括胶质瘤)组织样本中发现,并在整个肿瘤组织中表达出肿瘤特异性和一致性。这强调了其作为一种新型胶质瘤特异性标记物因而具有开发新的靶向药物的潜力。于是,研究者筛选了一个名为BTP-7靶向肽,该肽在血清中稳定,可以穿过BBB,特异性结合dg-Bcan。于是,就将该多肽与喜树碱(camptothecin,CPT)通过二硫键偶联,得到多肽偶联药物BTP-7-CPT。实验结果表明,该多肽偶联药物在体外对患者源性脑胶质瘤干细胞表现出抑制作用,在人源性脑胶质瘤颅内异种移植(patient-derived tumor xenograft,PDX)小鼠模型中增加了对肿瘤部位的药物输送。而且,与健康脑组织相比,该多肽偶联药物还增强了肿瘤毒性,并延长了动物的生存期。但该化合物仍存在一些不足,虽然天然BTP-7在人血清中稳定超过12小时,但BTP-7-CPT多肽偶联药物在1小时内完全降解,这表明在还未到达肿瘤部位时,血液中的二硫键很可能已经被裂解。因此,需要提高该化合物在血液中的连接基团的稳定性。
1.3 有效载荷
脑靶向肽偶联药物中的有效载荷,不只局限于治疗药物,还可以是造影剂。将药物与脑靶向多肽偶联后,可以改变药物的理化性质,如溶解度、选择性和半衰期等,使药物具有选择性,可以提高原本药物的疗效,减少毒副作用,改善溶解度,增加吸收。
但如果能够使用不同的成像方式对发病部位的结构功能成像,确定病变部位和状态,就可以更加精准地诊断和治疗疾病。例如美国食品和药物管理局(Food And Drug Administration,FDA)批准的首个含放射性核素的多肽偶联药物111In-DTPA-Octreotide(octrescan),用于治疗神经内分泌肿瘤。然而,研究表明奥曲肽(octreotide)扫描对治疗肿瘤的作用有限,因此该药物就主要用于诊断。而大脑的结构和功能更为复杂,如果能对其成像观察病理生理状态,可以达到更好的治疗效果。近年来为了同时解决药物定位、药物释放和药物疗效的相关问题,已经探索了将药物和显像剂组合在分子或纳米级平台上的多成分结构,称为治疗诊断剂。这种方法,有望显著改善治疗效果欠佳的脑部疾病,如体内分子神经成像等。Ben Woods等设计了[[99mTcO4]−CPepH3]复合物,PepH3多肽为脑靶向肽,CPepH3为客体,99mTcO4放射性标记为主体。研究表明,该复合物能够穿过BBB,其脑积累量高于其他用于脑靶向传递的肽。CPepH3结构呈笼状结构,该笼状支架可以使用不同的技术进行正交成像,如为正电子发射断层扫描成像术(Positron Emission Tomography,PET)设计的客体笼和为磁共振成像(magnetic resonance imaging,MRI)设计的主体笼等。同样,这些超分子金属基结构的坚固性和模块化组成可以引入靶向部分,如多肽或抗体等。目前,该实验室正在探索实现具有不同功能的异质笼,同时封装抗癌药物在内,如顺铂等。
2常见的脑靶向肽偶联药物
2.1 ANG1005(GRN1005)
ANG1005是由一分子Angiopep-2多肽和三分子的PTX通过可裂解的琥珀酰酯偶联而成的,Angiopep-2以LRP-1为靶点,使其穿过血-脑脊液屏障(Blood-Cerebrospinal fluid Barrier,BCB)和BBB,进入肿瘤细胞,在肿瘤细胞中裂解出PTX以发挥其抗肿瘤活性。原位脑灌注实验显示,ANG1005进入大脑的量比PTX更大,并且可以绕过BBB上的P-糖蛋白(P-glycoprotein,P-gp)。体外实验证明ANG1005对人类癌细胞株的抗肿瘤效力与PTX相似;体内实验证明ANG1005对人肿瘤异种移植的抑制作用比PTX更有效,可显著提高脑内植入U87MG胶质母细胞瘤细胞或NCI-H460肺癌细胞的小鼠的存活率。在I期研究中,单次静脉注射该多肽偶联药物,在3-6小时后切除的复发性胶质瘤中可以检测到治疗浓度的ANG1005,这为其通过BBB转运和肿瘤渗透提供了有力证据。在复发性乳腺癌脑转(brain metastases from breast cancer,BCBM)、伴或不伴有软脑膜癌症(leptomeningeal carcinomatosis subset,LMC)的II期临床研究中,ANG1005每3周静脉注射600mg/m2,77%颅内和86%颅外患者获益,主要表现为病情稳定或更好;在软脑膜癌症中,79%的患者颅内疾病得到控制,估计中位总生存期为8.0个月(95%置信区间,5.4~9.4个月)。一项注册号为NCT03613181的III期临床试验正在进行中,目的是观察与医生选择的最佳药物相比,ANG1005是否可以延长新近诊断为LMC并曾治疗过脑转移的HER2阴性乳腺癌患者的生存期。
2.2 DA-TP10
帕金森病(Parkinson's disease,PD)是一种常见的进行性神经退行性疾病,但治疗效果并不完全令人满意。目前PD治疗的主要难点之一是药物BBB渗透性较差。研究者设计选用细胞穿透肽TP10作为药物载体,采用“click”反应,偶联多巴胺(Dopamine,DA)。实验结果表明,该多肽偶联药物具有比DA更好的药代动力学和药效学性能。它可穿过BBB,进入脑组织,对儿茶酚-O-甲基转移酶的O-甲基化反应的敏感性较低,甚至低于DA,对多巴胺1型受体(dopamine receptor1,D1)和多巴胺2型受体(dopamine receptor2,D2)受体的亲和力较高,如在D1受体的情况下,远高于DA。在药物诱导的PD临床前动物模型中,与左旋多巴(L-DOPA)相比,抗帕金森活性更明显。因此,治疗PD的药物与CPPs的结合可能会成为一种治疗PD的新策略。
2.3 M6G-Ang
尽管脑靶向肽偶联药物有很多优点,但仍存在一些局限性。由于其分子量较生物大分子低,稳定性较差,肾脏可快速清除,半衰期和循环周期较短,可能导致药物疗效有限。此外,因为胃肠道有多种酶类,会使多肽在胃肠道内降解,故此类药物不适合口服给药,常用的给药方式是静脉注射,致使患者依从性差。目前,研究者也通过不同的技术来克服这些挑战。
3.1 对多肽自身结构的修饰
目前,研究者常采用环化肽(头尾环化、二硫键环化等)、拟肽、订书肽、bicycle策略、用D-氨基酸代替L-氨基酸等,增强多肽的稳定性,以此来延长半衰期。RAP12肽来源于受体相关蛋白(receptor associated protein,RAP)的微型化,与LRP-1具有结合亲和力。然而,当其脱离稳定蛋白环境时,RAP12表现出弱的α-螺旋片段。考虑到α-螺旋结构是该肽中介导配体-受体相互作用的常见结构基序,研究者利用肽吻合器技术合成了订书肽stapled RAP12(ST-RAP12)。经验证,与RAP12相比,优化后的ST-RAP12具有更高的α-螺旋含量、与LRP-1的结合亲和力和血清稳定性。此外,ST-RAP12表现出对bEnd.3细胞、U87胶质瘤细胞和人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)内化增强。而且,ST-RAP12在体外克服BBB和血脑肿瘤屏障(blood–brain tumorbarrier,BBTB)的能力也增强了。进一步应用ST-RAP12肽修饰高分子材料,构建ST-RAP12胶束。实验结果表明,该胶束在体内外可以有效穿透BBB/BBTB并靶向胶质瘤。此外,ST-RAP12胶束能有效地向胶质瘤传递PTX,延长胶质瘤荷瘤小鼠的生存时间,抑制肿瘤血管生成,诱导胶质瘤细胞凋亡,具有明显的抗胶质瘤作用。处于临床试验阶段的BT1718,是由双环肽通过可裂解的二硫键与美登素(mertansine,DM1)偶联得到的。双环肽可以特异性结合膜型1基质金属蛋白酶(MT1-MMP),MT1-MMP在乳腺癌、肺癌、卵巢癌、结肠癌等恶性肿瘤中过表达。与ADC相比,BT1718分子量低,分布良好,可快速穿透并“杀死”肿瘤细胞,对晚期实体瘤有治疗作用。已有大量研究表明Angiopep-2修饰的纳米载体显著增加了脑分布。Wei等构建了Angiopep-2的反向异构体,命名为DAngiopep-2,建立了脑靶向药物输送系统。虽然在体外实验中,DAngiopep-2被大脑毛细血管内皮细胞摄取的效率比LAngiopep-2低,但它表现出了增强的稳定性,并且修饰后的胶束比LAngiopep-2修饰后的胶束在正常的大脑和颅内胶质母细胞瘤细胞中具有更高的分布。
3.2 与化学大分子的结合修饰
多肽的电荷也与药物清除率有关。带负电荷的多肽序列比带正电荷的有更长的半衰期,这是因为肾小球内膜上阴离子电荷的存在限制了尿液中阴离子化合物的过滤。此外,还可通过增加多肽的大小和血浆蛋白结合,以防止结合物通过肾脏被过滤出来。有一种策略是将聚乙二醇(polyethylene glycol,PEG)与脑靶向肽药物偶联,可以延长半衰期。PEG的固有性质使其成为改性的理想候选材料:便宜、亲水、生物相容性、非免疫原性。它是最广泛使用的非天然聚合物之一,用于增加肽的溶解度、降低免疫反应和提高肽的生物利用度。PEG聚合物分子中的每个氧原子都能结合两到三个水分子,这样会大大增加附着在其上的化合物的质量和溶解度。FDA也批准了多种聚乙二醇化蛋白质,如PEG-牛腺苷脱氨酶和PEG-α-干扰素等。但分子量至少为30kDa聚乙二醇化的多肽会导致其在各种器官中的空泡化,如肾脏、肝脏、脾脏、骨髓等。因此,PEG天然替代品被开发出来。最突出的替代品是PASylation和XTEN。XTEN是由丙氨酸(A)、谷氨酸(E)、甘氨酸(G)、脯氨酸(P)、丝氨酸(S)和苏氨酸(T)这六种化学稳定氨基酸的非重复随机片段组成的遗传融合多肽。这些氨基酸的选择是基于避免可能影响蛋白质溶解度、活性或稳定性原则。艾塞那肽与XTEN偶联可显著改善肽的药代动力学,将其在大鼠、小鼠或猴子体内的半衰期分别延长65、71或125倍。PASylation化是指脯氨酸(P)、丙氨酸(A)和丝氨酸(S)的聚合物。由这些氨基酸组成的聚合物被认为对肽的水力动态体积与PEG有类似的影响,并且是可生物降解的,已经成功应用于超过10种的第一代生物制剂,包括人类生长激素、瘦素、促红细胞生成素、艾塞那肽、尿酸酶和凝血因子等。
3.3 剂型修饰
4小结
但由于多肽的特性,也使其应用受到一定的限制。目前,研究者也发明了许多新技术,用来克服这些缺点,如对其结构修饰、与生物大分子偶联和剂型修饰等。随着相关技术的发展,如来自噬菌体、酵母展示、嗜神经病毒和干细胞的肽库的新型筛选平台以及基于特定靶点的计算机模拟设计,研究者将开发出更好的BBB选择性、更高的转运能力、更强的代谢稳定性的脑靶向肽。相信在未来脑靶向肽偶联药物输送系统可以取得实质性进展,在CNS疾病治疗中发挥其独特优势。